III. UNE STABILISATION REMISE EN CAUSE
La stabilisation progressive de l'AFSSAPS à un régime de croisière exigeant constitue un objectif à la fois essentiel au regard des impératifs de sécurité sanitaire et ambitieux par rapport aux « rigueurs du terrain » du domaine et aux mouvements institutionnels qui l'affectent.
Les « rigueurs du terrain » dans le domaine des produits de santé illustreront d'abord les multiples développements qui accroissent sensiblement la charge d'activité de l'AFSSAPS ; la dimension européenne des compétences de l'Agence en est souvent à l'origine.
Les mouvements administratifs et institutionnels recouvrent plus précisément les modifications imprévues, voire intempestives, du périmètre de compétences de l'Agence et qui accroissent ses charges.
3.1 La croissance des activités dues aux circonstances
3.1.1. L'exemple de la veille sanitaire
* La fonction de veille sanitaire est exercée par l'AFSSAPS sur la sécurité d'emploi et la qualité des produits de santé. Cette fonction fait appel à la vigilance exercée sur chaque produit, mais aussi au contrôle de la qualité des produits.
Le département des alertes chargé de la gestion de celles-ci propose au directeur général toute mesure de retrait de lots ou de produits et veille à l'exécution des décisions. L'année 2003 a été de nouveau marquée par une forte croissance du nombre de signalements ainsi que l'illustre le tableau ci-dessous :
Veille sanitaire des médicaments
|
Veille accidents pour le médicament |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
|
Nombre de signalements |
162 |
149 |
182 |
254 |
353 |
424 |
579 |
|
Nombre de décisions de rappels de lots |
60 |
37 |
36 |
47 |
47 |
58 |
64* |
|
Nombre d'alertes sans retrait |
14 |
4* |
*sur les 68 alertes, dont 64 retraits :
- 24 étaient destinées aux officinaux (n° d'alerte en A)
- 9 étaient destinées aux établissements de santé (n° d'alerte en B)
- 13 étaient destinées aux officinaux et aux établissements de santé (n° d'alerte en A/B)
- 22 étaient sans n d'alerte (nombre réduit des destinataires hospitaliers prévenus directement par l'industriel sans passer par le système I-Media avec les fichiers complets).
Le doublement en trois ans du nombre de signalements permet de mesurer la croissance de l'activité de veille.
* La même constatation pouvait être faite pour les enquêtes spéciales. Regroupée au sein d'une équipe dédiée, l'activité des enquêtes spéciales relève du traitement et du suivi administratif, disciplinaire et pénal des affaires relatives à :
des produits de santé mis sur le marché en infraction avec le code de la santé publique et susceptibles de présenter un danger pour la santé publique ;
des entreprises ayant une activité dans le domaine des produits de santé en infraction avec la réglementation.
En 2003, 149 nouveaux dossiers ont été enregistrés auxquels il convient d'ajouter la poursuite de l'instruction des dossiers enregistrés en 2002 (60).
* La veille toxicologique constitue une branche de la coordination des vigilances des produits de santé ; il s'agit ici de la surveillance des effets toxiques des substances chimiques et biologiques (matière première, principe actif, excipient, emballage ...) entrant dans la composition ou la fabrication des produits de santé (médicaments, cosmétiques, dispositifs médicaux ...) et de l'analyse de ces effets pour mener des actions d'alerte, de prévention, de formation et d'information (sécurité sanitaire).
* Par ailleurs, dans le cadre des impératifs de la lutte contre le terrorisme, l'AFSSAPS est amenée à participer à des travaux et recherches évidemment non envisagés par la loi de 1998.
Ainsi, l'Agence participe (sous l'égide de la DGS et du haut fonctionnaire de défense) aux groupes de travail (Biotox et Piratox menace chimique pour ce dernier). Par ailleurs, l'AFSSAPS est chargée du contrôle de l'usage (mise en oeuvre, transport, importation, exportation) de microorganismes ou toxines susceptibles, par utilisation frauduleuse, de porter atteinte à la santé publique. Elle est compétente pour proposer et mettre en oeuvre la réglementation dans ces domaines. Elle participe à l'expertise auprès du ministère des affaires étrangères sur les questions de chimie et de biologie intéressant la défense : contrôle de biosécurité et des agents pathogènes. Enfin, elle est appelée à donner son avis sur les exportations à usage dual.
Ainsi, au-delà des fonctions de veille classique dont le volume peut sérieusement croître en intensité, surtout lorsque certains risques émergents se précisent (cf. infra), l'AFSSAPS est appelée à exercer des fonctions nouvelles de défense dans le cadre d'un périmètre d'activités qui est réputé rester « constant ».
3.1.2. Le nouveau régime des essais cliniques
Les essais cliniques étaient depuis la loi du 20 décembre 1988 régentés par la loi sur la protection des patients, dite « loi Huriet ». La France a acquis dans ce domaine une position de référence et les différents intervenants ont souhaité qu'elle puisse la maintenir. Or certains Etats-membres réduisent les délais et limitent les contraintes (Grande-Bretagne, Allemagne, Belgique). Ainsi, dès 2003 on a enregistré un tassement de 5 % à 10 % des essais déclarés en France contre une croissance du même ordre en Grande-Bretagne et en Allemagne, mais beaucoup plus élevée notamment en Belgique, en Espagne et aux Pays-Bas. L'attractivité de notre pays est, de ce fait, affaiblie.
Une première série de modifications importantes avait été apportée avec la loi du 4 mars 2002 sur les droits des malades : information des participants sur les résultats globaux de la recherche, rôle de la « personne de confiance » dans la recherche en situation d'urgence, dispense d'autorisation préalable pour certaines recherches sans bénéfice individuel direct.
La directive 2001/20/CE implique une révision d'ensemble du dispositif existant jusque là. La transposition de la directive en droit français a été réalisée dans le cadre de la loi de santé publique du 8 août 2004. Le changement fondamental réside dans le passage d'un régime déclaratif simple à un régime d'autorisation des essais. On peut noter d'autres modifications comme l'adaptation des conditions de participation des personnes vulnérables et la mise en place d'une base de données des essais cliniques notamment dans une perspective européenne.
Dans la perspective de ce changement de système, les inspections générales (audit page 33) notaient à la fin de l'année 2002 :
« Ainsi, en matière d'essais cliniques, l'entrée en vigueur au 1 er mai 2004 d'une nouvelle directive va se traduire par une évolution significative de la nature des travaux et leur ampleur. Or, ce surcroît de travail n'a pas été anticipé par le recrutement progressif de personnel scientifique compétent pour évaluer les protocoles d'essais dans des délais contraints, alors même que les missions actuelles de l'unité « essais cliniques » de la DEMEB ne sont que difficilement remplies avec les effectifs actuels. Ce nouveau dispositif affectera également la DIE, s'agissant de l'autorisation parallèle des sites d'essais cliniques ».
La charge accrue de travail pour l'AFSSAPS n'a pas été ignorée. La demande d'autorisation d'essai clinique, qui concerne tous les produits de santé, devra être examinée dans un délai maximal de 60 jours ; au cours de l'essai, l'Agence aura également à se prononcer sur chaque autorisation d'amendement. Enfin, elle aura à réceptionner les informations sur les fins d'essais cliniques et leurs résultats alors qu'aujourd'hui elle ne reçoit que les déclarations de fins d'essais prématurés.
En 2003, à titre d'indication, l'AFSSAPS a enregistré 1100 déclarations d'essais cliniques portant sur les médicaments et 2300 amendements.
Le rapport annuel 2003 de l'AFSSAPS (page 76) précise à ce sujet les conséquences pour elle du nouveau système :
« La mise en oeuvre de la directive nécessite la mise en place de structures à l'AFSSAPS en charge de l'évaluation des essais en France et de leur inspection. La modification essentielle du système actuel provient en effet de l'introduction d'un système d'autorisation des essais - soit implicite, soit explicite - par l'autorité compétente, qui confère à l'AFSSAPS des responsabilités et des contraintes, notamment de délai, nouvelles.
Une phase pilote - Afin de préparer l'ensemble des acteurs du système, l'AFSSAPS propose aux promoteurs depuis novembre 2003 une phase pilote simulant la procédure à venir d'autorisation préalable d'essai clinique. Cette phase se limite dans un premier temps à l'évaluation des dossiers de demande d'autorisation pour essais cliniques de médicaments en phase 1 en France et s'adresse à tous types de promoteurs d'essais. L'objectif est de vérifier si le contenu des dossiers à soumettre est adapté et applicable aux différentes situations et de mesurer la praticabilité du système d'évaluation dans un délai maximum de 30 jours pour ce type d'essais. Elle devrait être étendue dans un second temps à d'autres essais puis au suivi des essais après leur mise en place ».
Il s'agit là encore d'une charge nouvelle qui n'était pas prévue dans les activités déterminées par la loi de 1998.
3.1.3. Le contrôle des vaccins
Depuis le 1993, la France a vu l'activité de contrôle des vaccins en laboratoire augmenter considérablement : libération des lots de vaccins pour laquelle elle est devenue la première autorité nationale pour le nombre. Le rapport annuel 2003 de l'AFSSAPS (page 25) souligne encore une croissance de l'activité et esquisse les conséquences de la nouvelle réglementation :
« Le contexte d'élargissement de l'Union européenne et le fait que la France apporte un fort soutien aux actions de l'OMS auront pour conséquence une demande accrue d'expertise de la part des fabricants de vaccins et des instances européennes et internationales.
Une optimisation des procédures de contrôles et de mise à disposition des vaccins devient nécessaire pour l'AFSSAPS pour, d'une part garantir la qualité des médicaments immunologiques dans des délais compatibles avec les besoins du marché, et d'autre part, pour faire face à des urgences de santé publique (épidémies, contrefaçons), ou apporter un support technique ou réglementaire aux pays tiers.
Une projection basée sur les données conjointes des fabricants et des agences des Nations Unies en charge des programmes de vaccination peut être faite pour les deux années à venir :
Ce nouveau défi européen et international nécessite pour l'AFSSAPS d'ajuster sa stratégie globale de contrôle des vaccins et de poursuivre ses efforts d'investissements en matériels de haute technologie. L'Agence s'y est progressivement préparée par des aménagements de structure sur le site de Lyon, l'appel à l'expertise en matière de bio-statistiques, la mise en place de plans annuels, la réduction des essais in vivo.
Toutefois, cette stratégie de maîtrise des contrôles atteint ses limites dans la mesure où les perspectives nationales, européennes et internationales laissent envisager une extension de la « certification » des vaccins du marché. Une réflexion sur l'évolution de la réglementation européenne à partir des données issues du suivi statistique de la qualité des lots et des observations de non-conformités (1 à 5 % des lots testés suivant la nature du vaccin) devra certainement être initiée ».
3.1.4. La mobilisation due à la dimension européenne
A l'activité de l'AFSSAPS dans la sphère européenne constituée par les essais cliniques, les produits immunologiques (vaccins) et les procédures d'AMM centralisées ou de reconnaissance mutuelle s'ajoutent d'autres domaines.
Il convient de rappeler que dans le cas des procédures d'AMM, la charge de travail accrue par le dispositif européen a pour contrepartie logique une diminution de la charge afférente aux procédures nationales. Mais cette compensation ne s'observe pas dans les autres domaines.
* Ainsi, en matière de contrôle des laboratoires et des sites de fabrication de matières premières à usage pharmaceutique, l'AFSSAPS participe, entre autres, au réseau européen des laboratoires de contrôle des médicaments crée en 1995 par la Direction européenne de la qualité du médicament (dans le cadre du Conseil de l'Europe). Pour le contrôle des médicaments sous AMM européenne centralisée, les laboratoires de l'AFSSAPS sont compétents pour intervenir ; signalons que la France est après l'Allemagne le deuxième pays le plus choisi pour effectuer ces contrôles.
Par ailleurs, l'élaboration de la pharmacopée, actuellement à 81 % européenne, appelle une contribution permanente de la Direction des laboratoires et des contrôles de l'Agence.
* Enfin, les services d'inspection de l'AFSSAPS sont toujours sollicités au sein de l'Union européenne pour des audits, soit dans le cadre de l'élargissement, soit dans celui des procédures de reconnaissance mutuelle avec les pays tiers.
* La participation à l'élaboration des textes européens auxquels peuvent s'ajouter les dispositions nationales constitue une part importante de l'activité de toutes les directions de l'AFSSAPS. On peut citer, outre les questions déjà abordées : les directives relatives aux cellules, aux plantes, à la libéralisation de la publicité vers le grand public pour certains produits, la rédaction de référentiels européens sur les dispositifs médicaux.
* La participation aux nombreux groupes de travail européens mobilisant aussi dans une proportion significative l'énergie des agents de l'AFSSAPS (sur les antibiotiques par exemple).
L'importance de ces charges n'est pas contestée, mais les inspections générales dans leur audit ont mis en lumière la « difficulté qu'éprouve l'AFSSAPS à mesurer la portée de sa mobilisation en matière européenne » (page 31).
Elles ajoutent à ce sujet :
« Même si la mission a bien conscience que tous les aléas du calendrier européen ne peuvent être maîtrisés par l'Agence, elle regrette, néanmoins, qu'aucun travail n'ait pu être conduit avec la tutelle sur ces questions, notamment pour être mieux en mesure d'anticiper les conséquences de la transposition de certaines directives, ou l'application de nouveaux mécanismes européens.
Cette anticipation est rendue plus difficile par le fait que l'Agence n'est pas en mesure de quantifier son actuelle charge de travail induite par l'activité européenne ».
La réponse apportée par l'AFSSAPS à cette remarque illustre la difficulté de cet exercice de mesure :
« Le directeur général prend acte de la nécessité de mieux évaluer l'activité européenne et de travailler à la mesure effective de ces activités. Il souligne cependant la difficulté à bien apprécier, de façon spécifique, l'activité européenne tant elle est, dans les faits, intégrée à l'activité quotidienne. C'est en particulier le cas, comme le souligne la mission, du champ des dispositifs médicaux ou de la pharmacopée, mais aussi de la pharmacovigilance, quelle que soit d'ailleurs la nature des procédures d'AMM (centralisée, de reconnaissance mutuelle ou nationale), ou de certains domaines d'inspection (matières premières en particulier).
Concernant l'harmonisation effective des systèmes de sécurité sanitaires européens, la mission souligne à juste titre l'importance stratégique de cet enjeu. Il est à préciser que la sécurité collective de l'ensemble des citoyens européens est non seulement dépendante de « la capacité collective des Etats membres à y apporter des garanties », mais également de la capacité individuelle de chaque Etat ».
Quant à l'évocation de « l'absence de travail en coordination avec la tutelle », elle a donné lieu à un échange assez vif qui témoigne de certaines difficultés relationnelles avec la DGS. Le directeur général de la santé a en effet noté que :
« L'Agence a toujours cherché à disposer de la plus grande indépendance possible au niveau de sa participation à l'activité communautaire, en invoquant à tort le caractère technique des questions traitées par certaines instances pour obtenir d'y représenter la France seule et en ne respectant pas toujours les règles fixées par le SGCI qui supposent que tous les documents destinés à la représentation permanente et reflétant des positions officielles passent par la DGS pour validation. Dans certains secteurs, la pratique récente a néanmoins montré des améliorations. Mais les modalités de la collaboration indispensable restent à parfaire dans un contexte difficile pour tout le monde qu'entraînent les délais anormalement brefs imposés par les procédures européennes ». (lettre en réponse du 24 juin 2003 déjà citée).
En conclusion de cette analyse des activités européennes de l'Agence, la mission d'audit des inspections générales conclut (page 34) :
« L'émergence d'un système européen avec les risques vus plus haut d'une sécurité sanitaire a minima a justifié jusqu'ici la forte implication de l'Agence à un niveau à la fois technique et stratégique afin d'obtenir des garanties de haut niveau appliquées également à l'ensemble des pays de l'Union.
Si ce souci ne peut être que loué, il n'en demeure pas moins qu'une participation systématique à la totalité des actions européennes, quelle que soit leur implication stratégique ne peut être envisagée à moyens humains constants, les thèmes de travail européens étant amenés à se développer. Aussi, cet enjeu devra-t-il être pris en compte dans le travail de priorisation des missions de l'Agence, à effectuer en liaison avec sa tutelle ».
Cette observation pleinement justifiée sur les possibilités de fonctionnement convenable à moyens humains constants peut être étendue à « l'accroissement des activités autres que de source européenne ». C'est encore plus vrai si l'on tient compte des modifications du périmètre de compétences.
3.2. La modification permanente du périmètre de compétences ; la commission de la transparence
Alors même que toutes les mesures permettant à l'AFSSAPS d'atteindre son régime de croisière dans les domaines nouveaux n'avaient pas été prises, des compétences supplémentaires lui ont été conférées. Il s'agit du FOPIM, puis du secrétariat de la commission de la transparence.
3.2.1. Le FOPIM
* La gestion du FOPIM (Fonds de promotion de l'information médicale et médico-économique) a été confiée par la loi de financement de la sécurité sociale de 2001 à l'AFSSAPS. Ce fonds, qui a été mis en place en 2002, participe totalement ou partiellement aux actions d'information et de communication en matière de bon usage des produits de santé, de prescription et de dispensation des médicaments.
La création de cet organisme semble avoir eu notamment pour objectif de structurer des actions en résolvant les conflits de compétences existant entre la DGS et l'AFSSAPS. Il n'apparaît pas que ce but ait été atteint, ni que la nouvelle structure ait comblé les manques que l'on aurait constatés. Mais les besoins de coordination demeurent et la suppression récente du FOPIM ne suffit pas à y répondre.
* L'éparpillement des fonctions dans le domaine de l'information sur le médicament est délicate ; elle a entraîné un enchevêtrement des fonctions. En présentant les choses simplement, on peut indiquer que jusqu'en 2003, l'investigation est faite par l'ANAES, la vigilance est assurée par l'AFSSAPS, la transparence par la Direction générale de la santé (commission de la transparence), les autres intervenants étant le FOPIM (alors dans la mouvance de l'AFSSAPS), et les caisses d'assurance maladie.
L'audit des inspections générales a souligné la difficulté d'organiser des missions qui se situent à la frontière des compétences de chacun notamment pour l'AFSSAPS, et donnait des esquisses (page 57) de solution :
« L'ensemble des activités qui s'appuie sur l'évaluation scientifique relève du champ de compétence de l'Agence. Ainsi, aucune ambiguïté n'existe s'agissant des vigilances.
En ce qui concerne l'observation des conditions réelles d'utilisation des produits de santé, il s'agit bien d'une mission de l'Agence, mais il est recommandé de supprimer l'observatoire des prescriptions et de réintégrer ses compétences dans un service propre de l'AFSSAPS.
Cette réintégration suppose une réflexion sur la finalité de l'évaluation postérieure à la mise sur le marché et sur les modalités d'organisation de l'Agence pour y répondre. En l'espèce, au vu des acteurs compétents en la matière dans le paysage institutionnel français, la structuration d'un département en charge de la maîtrise d'ouvrage de ces études, c'est-à-dire capable de piloter des études pharmaco-épidémiologiques sans les réaliser, constitue une voie médiane préconisée par la mission (...).
Par ailleurs, il convient de renforcer les travaux liés à la production de référentiels de bonne pratique, mission qui relève pleinement de l'Agence.
Cette action nécessite la constitution d'un pôle unique en charge de la production des référentiels de bonne pratique (fiches de transparence, recommandations de bonne pratique, fiches d'information thérapeutique). Ce pôle dédié à l'information scientifique trouverait efficacement sa place à la DEMEIS en raison des synergies possibles avec le contrôle de la publicité et l'activité de la commission de la transparence, le cas échéant. Il devrait travailler en étroite collaboration avec le département des vigilances de la DEMEB.
En matière de communication vers les professionnels de santé ou les usagers du système de soins, la frontière entre ce qui relève légitimement de l'Agence et ce qui pourrait être externalisé, est ténue. Si la production de référentiels techniques relève de l'Agence, leur diffusion requiert un réel renforcement de la cellule communication. En revanche, la mission estime que tout ce qui s'inscrit dans une logique de modification du comportement des acteurs ne relève pas de la sécurité sanitaire.
A cet égard, elle considère que l'activité du FOPIM risque de créer une confusion avec la propre communication de l'Agence. Dans ces conditions, la mission préconise qu'une réflexion soit engagée sur la possibilité de détacher cet organisme de l'AFSSAPS ».
3.2.2. La commission de la transparence
Le ministère de la santé a souhaité rationaliser cette organisation et un choix a été exprimé par un décret de septembre 2003 qui a transformé la direction des études médico-économiques et de l'information scientifique (DEMEIS) de l'AFSSAPS en créant un secrétariat général à la commission de la transparence (le titulaire de la DEMEIS a lui-même été nommé à ce nouveau poste) et lui rattachant le FOPIM.
L'un des principes de cette réforme était « d'autonomiser » le secrétariat de la commission de la transparence, conformément à sa spécificité qui la distinguait nettement des autres commissions. Son caractère scientifique exclusif a été affirmé et maîtrisé ; les 20 membres titulaires ayant voix délibérative sont désormais des scientifiques, les huit membres représentant les administrations, les représentants des organismes d'assurance maladie et de l'industrie pharmaceutique siégeant désormais à titre consultatif.
Ce réaménagement des structures répond à un souci de cohérence en mettant fin à une complexité excessive, elle-même génératrice de pertes d'énergie et de frictions ; toutefois, elle contredisait une observation faite par les inspections générales (page 58) :
« Il existe un lien entre l'appréciation du service médical rendu effectué par la commission de la transparence et les compétences médico-scientifiques de l'Agence. Pour cette raison, le rattachement de cette commission à l'Agence est justifié. En revanche, les décisions relatives à l'admission du remboursement ne relèvent pas de l'AFSSAPS ».
On touche la difficulté liée à l'ambivalence de travaux d'analyse scientifique, y compris le rapport bénéfice/risque et l'analyse économique au sens du service médical rendu.
* Cette nouvelle structuration des compétences n'aura pu être vraiment appréciée puisqu'une nouvelle organisation est mise en place avec le transfert de la commission de la transparence au sein de la Haute Autorité de Santé crée par la loi relative à l'assurance maladie du 13 août 2004 et la suppression de l'ANAES intégrée au sein de la nouvelle HAS. L'approche économique a ainsi entraîné l'instance qui a aussi en charge l'appréciation médico scientifique du médicament en dehors du périmètre de l'AFSSAPS.
En outre, la nouvelle HAS accueillera en son sein la CEPP (commission d'évaluation des prestations et des produits).
Le nouvel article L. 161-37 du code de la sécurité sociale (art. 35 de la loi du 13 août 2004) précise ainsi les compétences de la nouvelle HAS :
« Art. L. 161-37 - La Haute autorité de santé, autorité publique indépendante à caractère scientifique dotée de la personnalité morale, est chargée de :
1°) Procéder à l'évaluation périodique du service attendu des produits, actes ou prestations de santé et du service qu'ils rendent, et contribuer par ses avis à l'élaboration des décisions relatives à l'inscription, au remboursement et à la prise en charge par l'assurance maladie des produits, actes ou prestations de santé ainsi qu'aux conditions particulières de prise en charge des soins dispensés aux personnes atteintes d'affections de longue durée. A cet effet, elle émet également un avis sur les conditions de prescription, de réalisation ou d'emploi des actes, produits ou prestations de santé et réalise ou valide des études d'évaluation des technologies de santé.
2°) Elaborer les guides de bon usage des soins ou les recommandations de bonne pratique, procéder à leur diffusion et contribuer à l'information des professionnels de santé et du public dans ces domaines, sans préjudice des mesures prises par l'Agence française de sécurité sanitaire des produits de santé dans le cadre de ses missions de sécurité sanitaire.
3°) Etablir et mettre en oeuvre des procédures d'évaluation des pratiques professionnelles et d'accréditation des professionnels et des équipes médicales mentionnées à l'article L. 1414-3-3 du code de la santé publique ; (...)
En outre, d'autres dispositions précisent les prérogatives de la nouvelle HAS en matière « d'évaluation de service attendu d'un produit, d'un acte ou d'une prestation de santé » à laquelle elle peut procéder, mais prévoit également que :
« Sans préjudice des mesures prises par l'Agence française de sécurité sanitaire des produits de santé dans le cadre de ses missions de sécurité sanitaire et notamment celles prises en application du 2° de l'article L.5311-2 du code de la santé publique, la Haute autorité de santé fixe les orientations en vue de l'élaboration et de la diffusion des recommandations de bonne pratique de l'Agence française de sécurité sanitaire des produits de santé mentionnée à l'article L. 5311-1 du même code et procède à leur diffusion ».
Dans ce domaine des référentiels de bonne pratique, l'AFSSAPS verra donc « ses orientations en vue de l'élaboration et de la diffusion des recommandations de bonne pratique » fixées par la Haute Autorité de Santé, autorité publique indépendante à caractère scientifique tout en continuant à être sous la tutelle de la Direction générale de la santé du ministère.
Un schéma publié le 27 janvier 2005 par le journal « Le Monde » illustre bien le positionnement du « nouvel organisme dans la galaxie du contrôle de la santé ».
Un nouvel organisme dans la galaxie du contrôle de la santé
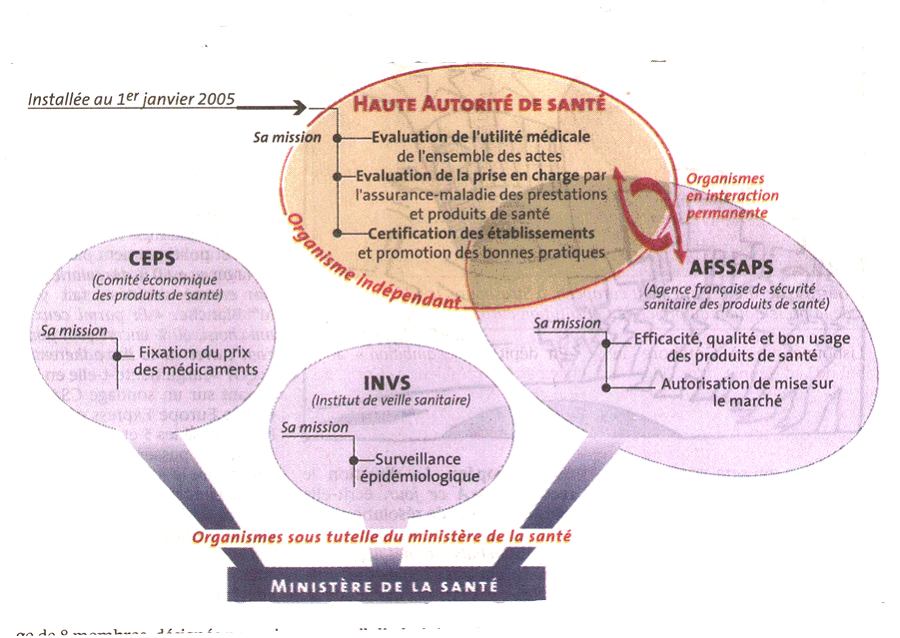
Source : Le Monde du 27 janvier 2005
La simplification souhaitée des différents côtés ne semble pas trouver ici la concrétisation que l'on pouvait espérer. La situation inédite dans laquelle ce domaine va se trouver nécessitera certainement de nouvelles clarifications.







