Rapport d'information n° 409 (2002-2003) de M. Adrien GOUTEYRON , fait au nom de la commission des finances, déposé le 16 juillet 2003
Disponible au format Acrobat (307 Koctets)
-
AVANT-PROPOS
-
I. D'UNE DIRECTION D'ADMINISTRATION CENTRALE
À UNE AGENCE RÉNOVÉE AUX COMPÉTENCES
ÉLARGIES
-
A. LES INSTANCES DIRIGEANTES
-
B. LES MISSIONS DE L'AFSSAPS
-
1. Des prérogatives renforcées
à l'égard de certains produits de santé
-
2. Des pouvoirs de police sanitaire
étendus
-
a) Les conditions d'engagement des pouvoirs de
police sanitaire de l'AFSSAPS
-
b) Les mesures de suspension
-
c) Les mesures d'interdiction
-
d) Les mesures entourant l'utilisation du
produit
-
e) La sanction de l'absence d'autorisation ou
d'enregistrement préalable : la suspension de
l'activité
-
f) La sanction de l'absence de conformité
aux conditions d'octroi de l'autorisation ou de l'enregistrement : le retrait
ou la suspension de l'autorisation ou de l'enregistrement
-
a) Les conditions d'engagement des pouvoirs de
police sanitaire de l'AFSSAPS
-
3. Des compétences étendues dans le
cadre de l'inspection
-
1. Des prérogatives renforcées
à l'égard de certains produits de santé
-
C. UNE EXPERTISE, INTERNE ET EXTERNE, ABONDANTE ET
PARFOIS DÉLICATE À MAÎTRISER
-
D. UNE TUTELLE DÉLICATE À
EXERCER
-
A. LES INSTANCES DIRIGEANTES
-
II. UNE AGENCE CONFRONTÉE À DES
PROBLÈMES DE CROISSANCE
-
III. POURSUIVRE LES MUTATIONS ENTREPRISES
-
A. L'ENGAGEMENT DE VÉRITABLES
EFFORTS
-
B. UNE ÉVALUATION DES ACTIVITÉS DE
L'AGENCE INSUFFISAMMENT TOURNÉE VERS L'EFFICACITÉ
-
A. L'ENGAGEMENT DE VÉRITABLES
EFFORTS
-
I. D'UNE DIRECTION D'ADMINISTRATION CENTRALE
À UNE AGENCE RÉNOVÉE AUX COMPÉTENCES
ÉLARGIES
-
EXAMEN EN COMMISSION
-
ANNEXES
-
ANNEXE N° 1 :
PERSONNES AUDITIONNÉES OU RENCONTRÉES LORS DE DÉPLACEMENTS PAR VOTRE RAPPORTEUR
-
ANNEXE N° 2 :
RÉPONSE DE L'AFSSAPS À UNE QUESTION DE VOTRE RAPPORTEUR RELATIVE À SA POLITIQUE IMMOBILIÈRE
N° 409
SÉNAT
SESSION EXTRAORDINAIRE DE 2002-2003
|
Annexe au procès-verbal de la séance du 16 juillet 2003 |
RAPPORT D'INFORMATION
FAIT
au nom de la commission des Finances, du contrôle budgétaire et des comptes économiques de la Nation (1) sur le contrôle portant sur l' Agence française de sécurité sanitaire des produits de sa n té ( AFSSAPS ),
Par M. Adrien GOUTEYRON,
Sénateur.
(1) Cette commission est composée de : M. Jean Arthuis, président ; MM. Jacques Oudin, Gérard Miquel, Claude Belot, Roland du Luart, Mme Marie-Claude Beaudeau, M. Aymeri de Montesquiou, vice-présidents ; MM. Yann Gaillard, Marc Massion, Michel Sergent, François Trucy, secrétaires ; M. Philippe Marini, rapporteur général ; MM. Philippe Adnot, Bernard Angels, Bertrand Auban, Denis Badré, Jacques Baudot, Roger Besse, Maurice Blin, Joël Bourdin, Gérard Braun, Auguste Cazalet, Michel Charasse, Jacques Chaumont, Jean Clouet, Yvon Collin, Jean-Pierre Demerliat, Eric Doligé, Thierry Foucaud, Yves Fréville, Paul Girod, Adrien Gouteyron, Hubert Haenel, Claude Haut, Roger Karoutchi, Jean-Philippe Lachenaud, Claude Lise, Paul Loridant, François Marc, Michel Mercier, Michel Moreigne, Joseph Ostermann, René Trégouët.
|
Santé publique. |
« Il est difficile d'effectuer une hiérarchisation parmi les missions absolument indispensables à l'AFSSAPS ».
Le président du conseil scientifique de l'AFSSAPS
Procès-verbal de la séance du conseil d'administration du 7 juin 2001
AVANT-PROPOS
Mesdames, Messieurs,
Le présent rapport d'information est issu d'un contrôle budgétaire effectué par votre rapporteur spécial des crédits de la santé, de la famille, des personnes handicapées et de la solidarité, en application des dispositions de l'article 57 de la loi organique du 1 er août 2001 relative aux lois de finances.
L'Agence française de sécurité sanitaire des produits de santé (AFSSAPS) a été créée par la loi n° 98-535 du 1 er juillet 1998 relative au renforcement de la veille sanitaire et du contrôle de la sécurité sanitaire des produits destinés à l'homme, et a succédé à l'Agence du médicament, elle-même créée en 1993.
L'Agence a fait l'objet de plusieurs contrôles , à la fois pour des raisons tenant aux enjeux de santé publique liés à la sécurité sanitaire des produits de santé, dans un contexte marqué par la multiplication de crises sanitaires et par la nécessité de réaffirmer le principe de précaution, et du fait de l'obligation de procéder à une évaluation de l'application de la loi.
En effet, l'article 30 de la loi du 1 er juillet 1998 précitée prévoit que celle-ci « fera l'objet, après évaluation de son application par le gouvernement et par l'Office parlementaire d'évaluation des choix scientifiques et technologiques, d'un nouvel examen par le Parlement dans un délai maximum de cinq ans après son entrée en vigueur ».
Aussi l'AFSSAPS a-t-elle d'abord été contrôlée par la Cour des comptes, qui a établi un relevé de constatations définitives, le 25 février 2003. Ce contrôle ne peut cependant être considéré comme un contrôle traditionnel de la haute juridiction financière, dans la mesure où il portait essentiellement sur les conditions de mise en place de l'Agence. La Cour des comptes a d'ailleurs indiqué à votre rapporteur qu'elle conduirait plus tard un contrôle « classique » de l'Agence.
La direction générale de la santé du ministère de la santé, de la famille et des personnes handicapées a ensuite demandé un audit de l'Agence à l'Inspection générale des finances (IGF) et à l'Inspection générale des affaires sociales (IGAS), estimant que de nombreux aspects de son organisation et de son fonctionnement étaient perfectibles.
L'IGF et l'IGAS ont ainsi mené un audit de l'AFSSAPS pendant six mois, qui a mobilisé six inspecteurs. L'audit effectué en commun par les deux inspections générales devrait se traduire par la production de douze rapports particuliers et d'un rapport de synthèse, qui, à la date de publication du présent rapport d'information, ne sont pas encore définitifs, la procédure contradictoire n'étant pas achevée. Cet audit porte sur les missions de sécurité sanitaire de l'Agence, alors que le contrôle de la Cour des comptes analysait davantage les fonctions support. Il constitue ainsi un exercice préalable à l'élaboration d'un contrat d'objectifs et de moyens qui doit permettre à l'Agence et au ministère de la santé, via la direction générale de la santé, de mettre en place des indicateurs de pilotage en vue d'une contractualisation pluriannuelle.
Les travaux de l'Office parlementaire d'évaluation des choix scientifiques et technologiques, qui doit évaluer l'application de la loi du 1 er juillet 1998 précitée et celle de la loi n° 2001-398 du 9 mai 2001 créant une Agence française de sécurité sanitaire environnementale (AFSSE), sont en cours, sur le rapport de notre collègue Bernard Seillier 1 ( * ) .
Le contrôle entrepris par votre rapporteur se veut complémentaire, et a essentiellement pour ambition d' appréhender l'adéquation des moyens de l'Agence à ses missions , bien qu'il soit moins étendu que l'étude engagée par l'Office, qui porte sur l'ensemble des agences de sécurité sanitaire, non seulement l'AFSSAPS mais également l'Agence française de sécurité sanitaire des aliments (AFFSA), l'Institut de veille sanitaire (InVS) et l'AFSSE.
*
* *
Votre rapporteur a procédé de manière traditionnelle pour effectuer ce contrôle.
Il a d'abord envoyé un questionnaire à l'AFSSAPS, puis a auditionné le directeur général de la santé et plusieurs responsables de l'Agence, avant d'effectuer des déplacements dans ses deux sites en province, à Lyon et à Montpellier, puis à son siège, à Saint-Denis.
Il a ensuite souhaité entendre les magistrats de la Cour des comptes et les membres de l'IGF et de l'IGAS qui avaient conduit les contrôles susmentionnés.
Suite à ces auditions, et aux informations particulièrement intéressantes qui lui ont été communiquées à cette occasion, votre rapporteur a adressé un second questionnaire à l'AFSSAPS, qui a répondu de manière très complète et argumentée, avec de nombreux documents annexés, dans un délai relativement bref.
Aussi se félicite-t-il des très bonnes conditions dans lesquelles son contrôle s'est déroulé.
Il tient à remercier l'ensemble de ses interlocuteurs, en particulier le directeur général de l'AFSSAPS et son adjointe, pour leur disponibilité et la qualité des réponses apportées à ses questions, notamment par la direction de l'administration et des finances de l'établissement, ainsi que les magistrats de la Cour des comptes et les inspecteurs des finances et des affaires sociales qu'il a auditionnés.
À ce titre, ce contrôle illustre une fois de plus les excellentes - et efficaces - relations nouées par la commission des finances du Sénat avec la haute juridiction financière et les corps d'inspection de l'administration.
*
* *
Votre rapporteur a pu observer un établissement à qui des tâches très importantes et à haute responsabilité ont été confiées, confronté à une montée en charge rapide ayant par conséquent engendré des dysfonctionnements, certes nombreux, mais qui sont avant tout, semble-t-il, le reflet de « problèmes de croissance ».
De fait, l'Agence a accompli un travail considérable en quelques années seulement, et se réforme progressivement, tout en menant à bien les missions qui lui ont été confiées par le législateur. Il convient donc de lui laisser du temps pour s'approprier ses missions nouvelles et pour adopter une culture professionnelle rénovée.
Il conviendra que le nouvel examen parlementaire des lois de 1998 et 2001 précitées s'inscrive dans le contexte instauré par la loi organique du 1 er août 2001 relative aux lois de finances, afin de pouvoir placer l'AFSSAPS en situation d'être véritablement évaluée sur ses performances, ce qui n'est pas encore le cas aujourd'hui.
I. D'UNE DIRECTION D'ADMINISTRATION CENTRALE À UNE AGENCE RÉNOVÉE AUX COMPÉTENCES ÉLARGIES
Les missions de l'AFSSAPS ont été d'abord assumées directement par le ministère de la santé, en particulier par le laboratoire national de la santé (LNS), administration centrale de l'Etat créée en 1950 et doté de statuts particuliers pour ces personnels scientifiques 2 ( * ) et techniques.
Le décret n° 93-697 du 25 mars 1993 disposait que le laboratoire national de santé était supprimé, l' Agence du médicament , créée par la loi n° 93-5 du 5 janvier 1993 relative à la sécurité en matière de transfusion sanguine et de médicament lui succédant. L'Etat avait ainsi rempli pendant plus de 40 ans les missions de contrôle sanitaire des produits de santé, avant de les déléguer à un établissement public.
L'Agence française de sécurité sanitaire des produits de santé (AFSSAPS) a été créée par le titre II de la loi n° 98-535 du 1 er juillet 1998 modifiée 3 ( * ) relative au renforcement de la veille sanitaire et du contrôle de la sécurité sanitaire des produits destinés à l'homme. Cette loi a également créé l'Institut de veille sanitaire (InVS) et l'Agence française de sécurité sanitaire des aliments (AFSSA).
Ces dispositions ont été codifiées. L'AFSSAPS fait l'objet du livre III de la 5 ème partie du code de la santé publique, dans sa partie législative. Ce livre III comporte 22 articles, numérotés L. 5311-1 à L. 5323-5, répartis en deux titres, le premier relatif aux missions et prérogatives de l'Agence, et le deuxième concernant son organisation.
Bien que succédant à l'Agence du médicament, l'AFSSAPS est en charge de missions beaucoup plus larges.
Il convient en outre d'ajouter que, à la différence des autres agences de sécurité sanitaire, la majorité des décisions de l'AFSSAPS, dans son champ de compétences, sont prises par le directeur général et non par le gouvernement sur avis de l'Agence.
A. LES INSTANCES DIRIGEANTES
L'organigramme de l'AFSSAPS est reproduit ci-contre, de même que celui de la direction générale.
Votre rapporteur, sur la question de l'organisation des structures administratives de l'Agence, souhaite simplement attirer l'attention sur deux points.
D'une part, il peut être observé une participation assez médiocre des membres, ou de leurs représentants, du conseil d'administration et du conseil scientifique de l'Agence aux réunions de ceux-ci.
Pour le conseil d'administration 4 ( * ) , qui s'était réuni à sept reprises en 2000 et en 2001 mais seulement trois fois en 2002, la lecture des procès-verbaux met en évidence le nombre important des membres absents. Certains d'entre eux n'ont même jamais participé aux réunions en 2002, à l'exemple de la direction de l'hospitalisation et de l'offre de soins (DHOS) du ministère de l'emploi et de la solidarité ou de la direction de la coopération européenne du ministère des affaires étrangères.
Au conseil scientifique, qui a tenu cinq réunions en 2000 et 2001 mais seulement trois en 2002, la situation est encore plus marquée puisque des réunions ont dû être reportées à plusieurs reprises, faute de quorum suffisant. Sur les dix séances du conseil scientifique qui ont eu lieu entre le 9 février 2001 et le 29 mai 2002, deux de ses membres n'ont jamais participé et deux autres n'y ont assisté qu'une seule fois. Au total, sur cette période, treize membres du conseil scientifique n'ont jamais participé à plus de la moitié de ses réunions.
Votre rapporteur ne peut dès lors que s'interroger sur la véritable implication de certains des membres des conseils de l'Agence, et, par conséquent, sur le rôle réel de ces instances 5 ( * ) .
D'autre part, les procédures administratives relatives au fonctionnement des conseils sont extrêmement longues . Ainsi, bien que le mandat des membres du conseil scientifique soit expiré depuis le 1 er juillet 2002, la procédure de renouvellement est toujours en cours. Depuis plus d'un an, le conseil scientifique n'a donc toujours pas de président !
B. LES MISSIONS DE L'AFSSAPS
Les missions de l'AFSSAPS sont définies par l'article L. 5311-1 du code de la santé publique.
|
L'article L. 5311-1 du code de la santé publique : la définition des missions de l'AFSSAPS L'Agence française de sécurité sanitaire des produits de santé est un établissement public de l'Etat, placé sous la tutelle du ministre chargé de la santé. L'agence participe à l'application des lois et règlements relatifs à l'évaluation, aux essais, à la fabrication, à la préparation, à l'importation, à l'exportation, à la distribution en gros, au conditionnement, à la conservation, à l'exploitation, à la mise sur le marché, à la publicité, à la mise en service ou à l'utilisation des produits à finalité sanitaire destinés à l'homme et des produits à finalité cosmétique, et notamment : 1° Les médicaments, y compris les préparations magistrales, hospitalières et officinales, les substances stupéfiantes, psychotropes ou autres substances vénéneuses utilisées en médecine, les huiles essentielles et plantes médicinales, les matières premières à usage pharmaceutique ; 2° Les produits contraceptifs et contragestifs ; 3° Les biomatériaux et les dispositifs médicaux ; 4° Les dispositifs médicaux de diagnostic in vitro ; 5° Les produits sanguins labiles ; 6° Les organes, tissus, cellules et produits d'origine humaine ou animale, y compris lorsqu'ils sont prélevés à l'occasion d'une intervention chirurgicale ; 7° Les produits de thérapie génique et cellulaire ; 8° Les réactifs de laboratoire ainsi que les réactifs conditionnés en vue de la vente au public et destinés au diagnostic médical ou à celui de la grossesse et les réactifs utilisés pour les examens d'anatomie et de cytologie pathologiques ; 9° Les produits destinés à l'entretien ou à l'application des lentilles de contact ; 10° Les produits insecticides, acaricides et antiparasitaires à usage humain ; 11° Les procédés, produits et appareils destinés à la désinfection des locaux dans les cas prévus à l'article L. 3114-1 ; 12° Les produits thérapeutiques annexes ; 13° Les aliments diététiques destinés à des fins médicales spéciales qui, du fait de leur composition, sont susceptibles de présenter un risque pour les personnes auxquelles ils ne sont pas destinés ; 14° Les lentilles oculaires non correctrices ; 15° Les produits cosmétiques. L'agence procède à l'évaluation des bénéfices et des risques liés à l'utilisation de ces produits et objets à tout moment opportun et notamment lorsqu'un élément nouveau est susceptible de remettre en cause l'évaluation initiale. Elle assure la mise en oeuvre des systèmes de vigilance et prépare la pharmacopée. Elle rend publique une synthèse des dossiers d'autorisation de tout nouveau médicament. Elle organise des réunions régulières d'information avec des associations agréées de personnes malades et d'usagers du système de santé mentionnées à l'article L. 1114-1 sur les problèmes de sécurité sanitaire des produits de santé. Elle contrôle la publicité en faveur de tous les produits, objets, appareils et méthodes revendiquant une finalité sanitaire. Elle prend ou demande aux autorités compétentes de prendre les mesures de police sanitaire nécessaires lorsque la santé de la population est menacée, dans les conditions prévues au présent code ou par toute autre disposition législative ou réglementaire visant à préserver la santé humaine. Elle établit un rapport annuel d'activité adressé au gouvernement et au Parlement. Ce rapport est rendu public. Elle organise des auditions publiques sur des thèmes de santé publique. |
La lecture de ces dispositions permet de constater que le champ de compétences de l'Agence est beaucoup plus large que celui de l'ancienne Agence du médicament, puisqu'il s'étend désormais à l'ensemble des produits à finalité sanitaire destinés à l'homme, y compris les produits à finalité cosmétique. Pour ces produits, elle est chargée d'assurer les missions d'évaluation, de contrôle et d'inspection. Elle peut également prendre des mesures de police sanitaire.
L'article L. 5311-2 du code de la santé publique précise la façon dont l'AFSSAPS remplit ses missions : elle est notamment en charge de l'expertise et du contrôle technique des produits entrant dans son champ de compétences. Dans ses secteurs d'activité, elle est le référent du ministère de la santé en matière d'expertise. En effet, elle assure également la fonction de vigilance sanitaire, en particulier par le recueil et l'évaluation des informations sur les effets indésirables ou inattendus liés à l'utilisation de ces produits, et celle d'alerte sanitaire en cas de risque pour la santé publique.
|
L'article L. 5311-2 du code de la santé publique : les moyens à la disposition de l'AFSSAPS En vue de l'accomplissement de ses missions, l'agence : 1° Procède ou fait procéder à toute expertise et à tout contrôle technique relatifs aux produits et objets mentionnés à l'article L. 5311-1, aux substances entrant dans leur composition ainsi qu'aux méthodes et moyens de fabrication, de conditionnement, de conservation, de transport et de contrôle qui leur sont appliqués ; elle exécute le contrôle de qualité des analyses de biologie médicale et des analyses permettant l'identification d'une personne par ses empreintes génétiques, et procède, à la demande des services concernés, à toute expertise technique nécessaire ; elle peut être chargée du contrôle de qualité d'activités utilisant des produits entrant dans son champ de compétence ; 2° Recueille les données scientifiques et techniques nécessaires à l'exercice de ses missions ; elle est destinataire des rapports de contrôle et de réflexion et des expertises réalisés dans son domaine de compétence par les services de l'Etat ou par les établissements publics qui lui sont rattachés ; elle recueille et évalue les informations sur les effets inattendus, indésirables ou néfastes des produits mentionnés à l'article L. 5311-1, ainsi que sur l'abus et sur la pharmacodépendance susceptibles d'être entraînés par des substances psychoactives, et prend, en la matière, dans son champ de compétence, toute mesure utile pour préserver la santé publique ; 3° Fournit au ministre chargé de la santé l'expertise qui lui est nécessaire en ce qui concerne les produits susvisés, notamment pour en permettre le bon usage ; elle participe à la préparation des textes législatifs et réglementaires ; elle propose aux ministres chargés de la santé et de la sécurité sociale toute mesure de leur compétence ; 4° Participe à l'action européenne et internationale de la France ; 5° Est chargée du fonctionnement de la commission de la transparence et de la commission mentionnée à l'article L. 1261-2 6 ( * ) . |
1. Des prérogatives renforcées à l'égard de certains produits de santé
Pour exercer ses missions, l'AFSSAPS dispose, par rapport à l'Agence du médicament, de prérogatives renforcées par les dispositions législatives et réglementaires à l'égard de certains produits de santé.
Les procédures déclaratoires ou d'autorisation ont été étendues.
Un régime déclaratoire est prévu pour :
- les dispositifs médicaux qui pourraient être à l'origine de risques sanitaires particuliers ;
- les établissements de fabrication, d'importation ou de distribution de matières premières à usage pharmaceutique (avec le principe d'opposabilité des bonnes pratiques), de dispositifs médicaux et de dispositifs médicaux de diagnostic in vitro .
Le régime d'autorisation concerne :
- les produits thérapeutiques annexes ;
- les essais cliniques portant sur les produits de thérapies génique et cellulaire.
2. Des pouvoirs de police sanitaire étendus
La loi du 1 er juillet 1998 précitée a confié à l'AFSSAPS des pouvoirs de police étendus :
- qui concernent tous les produits de santé, qu'ils soient soumis à autorisation ou non ;
- qui sont mis en oeuvre lorsque le produit présente ou est soupçonné de présenter, dans les conditions normales d'emploi, un danger pour la santé humaine ;
- qui consistent en des mesures de suspension, d'interdiction de toute activité portant sur ce produit, avec la possibilité de fixer des conditions particulières ou de restriction pour l'utilisation de ces produits.
Ainsi, dans le cadre de sa mission visant à garantir la sécurité sanitaire des produits de santé, la loi de 1998 habilite l'Agence à prendre « les mesures de police sanitaire nécessaires lorsque la santé de la population est menacée ».
En ce qui concerne les produits non soumis à autorisation ou enregistrement préalables , l'AFSSAPS est habilitée à prendre deux catégories de mesures à l'égard de ces produits : des mesures temporaires de suspension ou bien des mesures permanentes, c'est-à-dire des interdictions ou des conditions d'utilisation à caractère définitif (article L. 5312-1 du code de la santé publique).
L'Agence peut en outre moduler son intervention en fonction de la gravité du danger, avéré ou suspecté.
a) Les conditions d'engagement des pouvoirs de police sanitaire de l'AFSSAPS
En premier lieu, les produits visés par ces mesures sont ceux qui, non soumis à autorisation ou enregistrement préalables, présentent ou sont soupçonnés de présenter, dans des conditions normales d'emploi ou dans des conditions raisonnablement prévisibles, un danger pour la santé humaine.
L'article L. 5312-1 du code de la santé publique précité étend le champ de ces mesures non seulement aux produits présentant un danger avéré, mais également à ceux pour lesquels est établie une suspicion de danger.
La fixation d'un champ d'intervention pour l'Agence conçue d'une manière aussi large a pour but d' améliorer la prévention et la sécurité sanitaire .
En second lieu, sont également visés par ces dispositions, les produits qui sont mis sur le marché, mis en service ou utilisés en infraction aux dispositions législatives ou réglementaires qui leur sont applicables.
Cette hypothèse d'intervention est tout à fait caractéristique du pouvoir de répression administrative dévolue à l'AFSSAPS envers les contrevenants aux dispositions législatives et réglementaires entourant ces produits.
b) Les mesures de suspension
La loi du 1 er juillet 1998, avec l'article L. 5312-1 du code de la santé publique, confère à l'AFSSAPS le pouvoir de suspendre, en cas de danger ou de suspicion de danger, pour une durée n'excédant pas un an ou jusqu'à la mise en conformité du produit, en cas d'infraction aux dispositions législatives ou réglementaires, les essais, la fabrication, la préparation, l'importation, l'exploitation, l'exportation, la distribution en gros, le conditionnement, la conservation, la mise sur le marché à titre gratuit ou onéreux, la détention en vue de la vente ou de la distribution à titre gratuit ou onéreux, la publicité, la mise en service, l'utilisation, la prescription, la délivrance ou l'administration d'un produit.
Le champ d'application de cette mesure de suspension est donc extrêmement vaste puisqu'il vise l'ensemble des activités portant sur le produit, depuis sa conception jusqu'à son utilisation finale chez le patient.
c) Les mesures d'interdiction
En cas de danger grave ou de suspicion de danger grave, l'Agence peut interdire les activités décrites ci-dessus.
d) Les mesures entourant l'utilisation du produit
L'article L. 5312-1 du code de la santé publique ajoute aux mesures précitées des moyens d'intervention portant sur l'utilisation même du produit. Ainsi, l'AFSSAPS peut fixer des conditions particulières ou des restrictions pour l'utilisation des produits concernés afin de garantir leur sécurité sanitaire.
Le schéma ci-après récapitule les mesures de police sanitaire de l'AFSSAPS pour les produits qui ne sont pas soumis à autorisations ou enregistrement :
Mesures de police sanitaire
Produits non soumis à autorisations ou enregistrement :
Exemples : dispositifs médicaux, dispositifs médicaux de diagnostic in vitro , produits
cosmétiques, produits sanguins labiles, préparations magistrales, hospitalières,
cfficinales, matières premières à usages pharmaceutiques
Article L. 5312-1 du code de la santé publique
Suspension d'activité liée au produit (exemple :
fabrication, mise sur le marché, utilisation) :
- en cas de danger ou de suspicion de danger (pour une durée maximale d'un an)
- en cas d'infraction aux dispositions législatives et réglementaires (jusqu'à la mise en conformité)
Interdiction d'activité en cas de danger grave ou de suspicion de danger grave
Conditions particulières ou restrictions pour l'utilisation des produits concernés
Pouvoir de retrait du produit en tout lieu où il se trouve
Pouvoir de destruction lorsque celle-ci constitue le seul moyen de faire cesser le danger
Pouvoir d'ordonner la diffusion de mises en garde ou de précautions d'emploi
Source : AFSSAPS
Les produits soumis à autorisation ou enregistrement ou certification préalables sont régis par des dispositions spécifiques.
e) La sanction de l'absence d'autorisation ou d'enregistrement préalable : la suspension de l'activité
Concernant ces produits, l'article L. 5312-2 du code de la santé publique précise les sanctions administratives que peut prendre l'AFSSAPS lorsqu'un de ces produits est mis sur le marché, mis en service ou utilisé sans avoir obtenu l'autorisation, l'enregistrement ou la certification préalable, exigé par les dispositions législatives ou réglementaires applicables à ce produit.
Ces mesures consistent en une suspension, jusqu'à la mise en conformité du produit au regard de la législation et de la réglementation en vigueur, des activités portant sur ces produits, depuis les essais jusqu'à l'administration du produit, à l'instar de ce qui a été énoncé à l'article L. 5312-1 du même code, pour les produits non soumis à autorisation ou enregistrement préalable.
f) La sanction de l'absence de conformité aux conditions d'octroi de l'autorisation ou de l'enregistrement : le retrait ou la suspension de l'autorisation ou de l'enregistrement
A ces dispositions relatives à la sanction du défaut d'autorisation ou d'enregistrement préalable, s'ajoutent bien évidemment les mesures de police sanitaire spécifiques à chaque produit, lorsque ceux-ci, bien que revêtus desdites autorisations ou enregistrements, conformément aux textes en vigueur, ne répondent plus aux conditions ayant présidé à l'octroi des autorisations ou enregistrements.
Ce dispositif consiste en des mesures de modification, de suspension ou de retrait de ces autorisations ou enregistrements préalables et est décrit dans les parties du code de la santé publique propres à chacun de ces produits.
A titre d'exemple, les modalités d'octroi, de refus, de suspension ou de retrait des autorisations de mise sur le marché des médicaments figurent aux articles L. 5121-8 et R. 5128 à R. 5142 du code de la santé publique. De même, pour les dispositifs médicaux mentionnés à l'article L. 5211-1 du même code, la mise hors service de ceux-ci, en cas de non respect de l'obligation de s'assurer de leur performance et de leur maintenance, est prévue à l'article L. 5212-1 du même code.
Le schéma ci-après illustre les pouvoirs de police de l'AFSSAPS pour les produits soumis à autorisations ou enregistrement ou certification préalable :
Mesures de police sanitaire
Produits soumis à autorisations ou enregistrement
ou certification préalable :
Exemples : dispositifs médicaux, dispositifs médicaux de diagnostic in vitro (dont réactifs de laboratoire enregistrés), spécialités pharmaceutiques, médicaments homéopathiques
Mis sur le marché avec autorisation, enregistrement ou certification préalable
Mis sur le marché sans autorisation, enregistrement ou certification préalable
Textes spécifiques de police sanitaire :
Exemple : suspension d'AMM (L. 5121-8), retrait de réactifs en cas de danger grave pour la santé publique (L. 5133-7), mise hors service de dispositifs médicaux en cas de non respect de l'obligation de s'assurer de la performance de la maintenance de ces dispositifs médicaux (L. 5212-1)
Article L.5312-2
Suspension d'activité jusqu'à la mise en conformité
Article L. 5312-3
Pouvoir de retrait du produit en tout lieu où il se trouve
Pouvoir de destruction lorsque celle-ci constitue le seul moyen de faire cesser le danger
Pouvoir d'ordonner la diffusion de mises en garde ou de précautions d'emploi
Source : AFSSAPS
3. Des compétences étendues dans le cadre de l'inspection
L'AFSSAPS désigne, parmi ses agents, des inspecteurs auxquels est confié le contrôle de l'application des lois et règlements relatifs aux activités et produits de santé mentionnés à l'article L. 5311-1 du code de la santé publique, afin d'assurer le respect des règles de sécurité sanitaire entourant ces produits (article L. 5313-1 dudit code).
En outre, le même article permet aux inspecteurs de l'Agence de procéder, d'une part, au recueil des informations nécessaires à l'accomplissement des missions de l'Agence, et, d'autre part, aux contrôles relatifs à ces produits, aux substances entrant dans la composition, ainsi qu'à leurs méthodes et moyens de fabrication, de conditionnement, de conservation, de transport et de contrôle.
Enfin, les inspecteurs de l'Agence, habilités et assermentés à cet effet, ont qualité pour rechercher et constater les infractions pénales aux lois et règlements relatifs aux activités et aux produits relevant de sa compétence (article L. 5412-1 du code de la santé publique).
Ils peuvent être assistés par des experts désignés par le directeur général de l'Agence et procéder à des inspections conjointes avec des agents appartenant aux services de l'Etat et de ses établissements publics.
Outre les pouvoirs de dresser des procès-verbaux, de saisie et de prélèvements d'échantillons, les inspecteurs disposent de pouvoirs nouveaux ou élargis.
a) Le pouvoir d'accès aux locaux professionnels
Le nouveau libellé de l'article L. 5313-2 pour les inspecteurs de l'AFSSAPS, introduit par la loi du 1 er juillet 1998 précitée, est plus précis que le texte législatif antérieur puisqu'il prévoit cette possibilité d'accès, lorsqu'ils sont à usage professionnel, aux locaux, lieux, installations, véhicules de transport, dans lesquels ont vocation à s'appliquer les dispositions qu'ils contrôlent, à l'exclusion des domiciles et de la partie des locaux servant de domicile.
Ces mêmes articles prévoient en outre l'accès des inspecteurs à ces lieux, non seulement entre 8 heures et 20 heures mais également en dehors de ces heures, lorsque l'accès au public est autorisé ou lorsqu'une activité est en cours, qui peut donc être de nuit, par exemple.
Il convient de rappeler que, antérieurement, cette plage horaire était limitée aux horaires d'ouverture lorsque les lieux étaient ouverts au public, ou dans les autres cas, entre 8 heures et 20 heures.
En plus de l'infraction pénale que constitue le fait de faire obstacle aux réquisitions des inspecteurs (article L. 1425-1 code de la santé publique), ces articles prévoient que les inspecteurs ont désormais la possibilité de demander au président du tribunal de grande instance ou au juge délégué par lui, d'être autorisés à avoir accès à ces différents lieux lorsque cela leur est refusé, selon les modalités fixées par le code de procédure civile.
b) Le pouvoir d'accès aux données
À l'occasion de l'accès aux locaux professionnels, les inspecteurs de l'AFSSAPS disposent de compétences élargies depuis la loi du 1 er juillet 1998 en matière de communication d'information.
En effet, ils peuvent demander communication de tous documents nécessaires à l'accomplissement de leurs missions quel qu'en soit le support, et non plus uniquement les documents professionnels (articles L. 1421-3 et L. 5313-2 du code de la santé publique).
De même, ils ont désormais accès, pour les opérations faisant appel à l'informatique, aux logiciels et aux données. Ils peuvent en demander la transcription par tout traitement approprié sous la forme de documents directement utilisables pour les besoins du contrôle.
Toutefois, les données médicales individuelles sont accessibles aux seuls agents ayant la qualité de médecin afin de ne pas porter atteinte au secret médical.
c) La saisie et la consignation
Les pharmaciens inspecteurs de santé publique, les inspecteurs de l'AFSSAPS, dans le cadre de leurs missions de recherche et de constatation des infractions pénales, peuvent procéder à la saisie de produits. Toutefois, ce pouvoir de saisie est subordonné à une autorisation du président du tribunal de grande instance ou du juge délégué par lui, qui vérifie le bien-fondé de la demande, laquelle doit comporter tous les élément de nature à la justifier (articles L. 5411-3, L. 5412-1, L. 5413-1 du code de la santé publique).
Les inspecteurs disposent d'un pouvoir de consignation des produits suspectés d'être non conformes aux dispositions de la loi, dans l'attente des résultats d'analyse des échantillons prélevés ou de la communication des documents demandés (articles L. 5127-2 et L. 5313-1 du code de la santé publique introduits par la loi du 1 er juillet 1998).
Cette mesure de police de nature administrative donne lieu, dès lors qu'elle excède 15 jours, à une autorisation du président du tribunal de grande instance.
Le tableau ci-après récapitule les différentes compétences de l'AFSSAPS selon les produits :
|
Organes, tissus et cellules |
Produits sanguins labiles |
Produits de thérapies génique et cellulaire |
Médicaments |
Dispositifs de diagnostic in vitro |
|
|
Veille |
Recueil et analyse de données scientifiques et techniques |
Recueil et analyse de données scientifiques et techniques |
Recueil et analyse de données scientifiques et techniques |
Recueil et analyse de données scientifiques et techniques |
Recueil et analyse de données scientifiques et techniques |
|
Evaluation |
Autorisation préalable des procédés de préparation, conservation, transformation des tissus et cellules Autorisation d'établissements et de protocoles pour les essais cliniques sur les cellules
Autorisation importation/
|
Liste et caractéristiques des produits sanguins labiles
(PSL)
Autorisation à recourir à des PSL issus de
collectes hors territoire français
Autorisation d'importation de PSL et de pâtes plasmatiques |
Autorisation des produits de thérapie génique et
cellulaire après évaluation des procédés
Autorisation préalable des protocoles d'essais cliniques |
Déclaration/suspension/
Autorisation temporaire d'utilisation
Autorisation de mise sur le marché
Autorisation d'importation |
Enregistrement des réactifs |
|
Vigilance |
Biovigilance retrait d'autorisations Retrait de produits |
Avis sur le décret hémovigilance Retrait de produits Retrait d'agrément |
Suspension/
Retrait de produits |
Pharmacovigilance Modification, suspension ou retrait d'autorisation Retrait de produits Rappel de lots Suspension d'essais cliniques |
Réactovigilance Retrait d'enregistrement Retrait de produits Rappel de lots Suspension des activités de ces établissements |
|
Inspection |
Intervention sur place/prélèvement (consignation/saisie) Autorisation de lieux d'essais cliniques (sans bénéfice individuel direct) Autorisation des établissements exerçant des activités de conservation et de distribution |
Intervention sur place/prélèvement (consignation/saisie) Autorisation de lieux d'essais cliniques (sans bénéfice individuel direct) Agrément des établissements et autorisations de certaines activités annexes |
Autorisation des établissements et organismes effectuant des activités de préparation, conservation, distribution, importation et exportation Intervention sur place/prélèvement (consignation/saisie) Autorisation de lieux d'essais cliniques (sans bénéfice individuel direct) |
Intervention sur place/prélèvement (consignation/saisie) Autorisation de lieux d'essais cliniques (sans bénéfice individuel direct) Autorisation d'ouverture, de modification ou de fermeture d'établissement |
|
|
Contrôle en laboratoire |
Contrôle technique |
Contrôle technique |
Contrôle technique |
Certificats d'analyse |
Certificats d'analyse |
|
Norme sanitaire |
Proposition de texte au ministre de la santé
Avis pour les règles de bonnes pratiques des
organes
Préparation de texte pour les règles de bonnes pratiques des tissus et cellules |
Réglementation de l'utilisation et de la distribution des
PSL
Bonnes pratiques des établissements
Avis sur les conditions techniques, médicales et sanitaires d'agrément des établissements |
Proposition de texte au ministre de la santé |
Proposition de texte au ministre de la santé |
Proposition de texte sur les bonnes pratiques de fabrication, d'importation et de distribution des réactifs |
Les compétences selon les produits
|
Dispositifs médicaux |
Aliments diététiques destinés à des fins médicales spéciales |
Produits thérapeutiques annexes |
Cosmétiques |
Matières premières à usage pharmaceutique |
|
|
Veille |
Recueil et analyse de données scientifiques et techniques |
Recueil et analyse de données scientifiques et techniques |
Recueil et analyse de données scientifiques et techniques |
Recueil et analyse de données scientifiques et techniques |
Recueil et analyse de données scientifiques et techniques |
|
Evaluation |
Mise en oeuvre d'essais cliniques pour les dispositifs
médicaux à risque particulier : délai de deux mois
après information
Déclaration/suspension d'essais cliniques
Certification de conformité
Déclaration des dispositifs médicaux à risque particulier |
Déclaration avant mise sur le marché |
Autorisation de produits |
Déclaration/suspension d'essais cliniques Dossier à détenir et dépôt de formule (centre anti-poison) |
Spécifications de la pharmacopée |
|
Vigilance |
Matériovigilance Retrait ou restriction d'utilisation Contrôle de qualité des dispositifs médicaux dont la liste est fixée par arrêté du ministre Rappel de lots Suspension d'essais cliniques |
Suspension ou retrait du produit Suspension d'activité de l'établissement Rappel de lots Suspension d'essais cliniques Obligation de signalement des effets indésirables (fabricants, prescripteurs) |
Modification, suspension ou retrait d'autorisation Suspension activité de l'établissement Rappel de lots |
Cosmétovigilance Suspension/interdiction d'activité Retrait du produit Suspension d'essais cliniques |
Suspension/interdiction d'activité Retrait du produit |
|
Inspection |
Intervention sur place/prélèvement (consignation/saisie) Autorisation de lieux d'essais cliniques (sans bénéfice individuel direct) |
Intervention sur place/prélèvement (consignation/saisie) Autorisation de lieux d'essais cliniques (sans bénéfice individuel direct) |
Intervention sur place/prélèvement (consignation/saisie) |
Intervention sur place/prélèvement (consignation/saisie) Autorisation de lieux d'essais cliniques (sans bénéfice individuel direct) Déclaration des établissements |
Intervention sur place/prélèvement (consignation/saisie) Déclaration de l'activité d'importation, fabrication, distribution |
|
Contrôle en laboratoire |
Contrôle technique |
Contrôle technique |
Contrôle technique |
Contrôle technique |
Contrôle technique |
|
Norme sanitaire |
Proposition de texte au ministre de la santé |
Proposition de texte au ministre de la santé |
Proposition de texte au ministre de la santé |
Proposition de texte au ministre de la santé |
Bonnes pratiques de fabrication, d'importation ou de distribution : arrêté du ministre sur proposition de l'Agence |
|
Source : AFSSAPS |
|||||
C. UNE EXPERTISE, INTERNE ET EXTERNE, ABONDANTE ET PARFOIS DÉLICATE À MAÎTRISER
Si l'Agence a recours, dans une proportion importante, à une expertise externe, l'IGF et l'IGAS estiment que celle-ci n'est pas bien gérée, le fichier des externes étant, selon elles, « mal tenu ». Aucune réflexion ne serait conduite sur l'équilibre optimal à atteindre entre l'expertise externe et l'expertise interne.
En outre, l'Agence ne saurait pas vraiment s'assurer de l'indépendance de l'expertise externe, ni même de son expertise interne. Ainsi, elle aurait embauché un agent provenant du secteur privé qui ne serait resté que huit mois, au cours desquels il aurait contrôlé les activités de l'entreprise concurrente de son entreprise d'origine avant de retourner travailler dans cette dernière !
1. Une multitude de commissions techniques
L'AFSSAPS exerce ses missions, notamment au moyen des commissions d'experts qui sont placés près d'elle, au nombre de onze, ou dont elle assure le secrétariat, soit trois organismes.
|
Les 14 commissions placées dans l'orbite de l'AFSSAPS 1) Les commissions siégeant auprès de l'AFSSAPS La commission d'autorisation de mise sur le marché est obligatoirement consultée préalablement à toute décision d'octroi, de renouvellement, de refus ou de retrait d'une autorisation de mise sur le marché, ainsi que sur tout recours gracieux qui doit impérativement être formé avant le recours contentieux. La commission consultative d'enregistrement des réactifs est principalement chargée de donner des avis sur les dossiers de demandes d'enregistrement, la définition des critères de sensibilité et de spécificité, l'évaluation et la réévaluation des réactifs. Elle est obligatoirement consultée avant toute décision de retrait. La commission chargée du contrôle de la publicité et de la diffusion des recommandations sur le bon usage des médicaments émet un avis pour interdire ou rectifier la publicité auprès des professionnels de santé, en cas de manquement aux dispositions réglementaires (contrôle a posteriori ). Elle émet également un avis sur les publicités, les octrois, suspensions ou retraits de visas des publicités pour les médicaments et les produits présentés comme bénéfiques pour la santé destinés au public. La commission chargée du contrôle de la publicité en faveur des objets, appareils et méthodes présentés comme bénéfiques pour la santé émet un avis pour interdire la publicité sous quelque forme que ce soit relative à ces objets, appareils et méthodes lorsqu'ils ne présentent pas les propriétés annoncées. La commission nationale de pharmacovigilance est chargée d'évaluer les effets indésirables des médicaments et de certains produits de santé, de donner un avis sur les mesures à prendre et de proposer les enquêtes et travaux qu'elle estime utiles à l'exercice de la pharmacovigilance. La commission nationale de matériovigilance a pour mission d'évaluer les informations sur les incidents ou les risques d'incidents mettant en cause des dispositifs médicaux, de donner un avis sur les mesures à prendre et de proposer les enquêtes et les travaux qu'elle estime utiles à l'exercice de la matériovigilance. La commission nationale des stupéfiants et psychotropes est chargée de la surveillance des médicaments ou des substances non médicamenteuses susceptibles d'entraîner une dépendance. Elle formule un avis sur toute question concernant l'application des dispositions relatives aux stupéfiants et psychotropes. La commission nationale de la pharmacopée est chargée de préparer la rédaction de la pharmacopée française et du formulaire national qui la complète. La commission de cosmétologie est chargée d'émettre des avis sur la fixation des listes concernant les substances interdites ou limitées dans les produits cosmétiques. Elle peut, sur demande du ministre chargé de la santé, du directeur général de l'AFSSAPS ou de sa propre initiative, formuler des avis sur la sécurité des produits cosmétiques, leur composition, la toxicité d'ingrédients entrant ou susceptibles d'entrer dans leur composition. Elle peut également, à la demande du directeur général de l'Agence, formuler un avis sur les demandes présentées en application de l'article R. 5263-7 du code de la santé publique ainsi que sur les informations relatives aux effets indésirables liés à l'utilisation des produits cosmétiques dont l'Agence a connaissance. Le ministre chargé de la santé peut solliciter l'avis de la commission sur toute question ayant trait au domaine de compétence de celle-ci. Le groupe d'experts sur les recherches biomédicales est divisé en deux sous-groupes, l'un relatif aux recherches biomédicales ne portant pas sur des médicaments et produits assimilés, l'autre relatif aux recherches biomédicales portant sur les médicaments et produits assimilés. Le groupe d'experts donne notamment des avis sur la réalisation de recherches biomédicales et les lieux de recherche, examine les lettres d'intention des promoteurs de recherche biomédicale. Il examine également les effets indésirables graves des recherches biomédicales et propose, le cas échéant, toute mesure utile. Le groupe sur la sécurité virale des médicaments est chargé de donner un avis sur la sécurité des médicaments contenant des produits biologiques, au regard des virus et autres agents transmissibles, ou sur la surveillance des produits pour lesquels les méthodes de fabrication font appel à de tels produits. Sont concernés tous les produits faisant l'objet d'une demande d'autorisation de mise sur le marché, d'un essai clinique ou d'une autorisation temporaire d'utilisation. 2) Les commissions dont l'Agence assure le secrétariat La commission de la transparence, placée auprès des ministres chargés de la santé et de la sécurité sociale, donne un avis sur le bien-fondé de l'inscription des médicaments sur la liste des spécialités remboursables et/ou des médicaments agréés à l'usage des collectivités. Dans ce cadre, elle procède à l'évaluation du service médical rendu (SMR) et à l'évaluation de l'amélioration du SMR des médicaments. La commission de la transparence donne également un avis sur les documents d'information portant sur la comparaison des médicaments de la même classe pharmacothérapeutique (fiches de transparence). Cette analyse des données à caractère médical, pharmaceutique et épidémiologique se rapportant aux médicaments constitue la base des avis scientifiques rendus par la commission de la transparence à destination du ministère de la santé. La commission d'évaluation des produits et prestations a pour mission de fournir, aux ministres chargés de la santé et de la sécurité sociale, un avis sur le bien-fondé de l'inscription d'un produit et/ou d'une prestation sur la liste des produits et prestations remboursables. Elle évalue le service rendu et l'amélioration du service rendu des produits, définis à l'article L.165-1 du code de la sécurité sociale, pour lesquels un remboursement est demandé. L'analyse des données à caractère médical et épidémiologique se rapportant aux produits constitue la base des avis scientifiques rendus par la commission d'évaluation. La loi de financement de la sécurité sociale pour 2000 a confié à l'AFSSAPS le soin d'assurer le secrétariat de cette commission. Le comité d'orientation de l'observatoire national des prescriptions et consommations des médicaments dans les secteurs ambulatoire et hospitalier placé auprès des ministres chargés de la santé et de la sécurité sociale est chargé de recueillir, analyser et diffuser sous les formes appropriées les informations relatives à ces sujets. |
L'expertise interne que constitue cet ensemble de commissions aboutirait, dans certains cas, à une fuite de ses responsabilités par l'Agence.
Le directeur général de la santé a ainsi indiqué à votre rapporteur que le mode actuel du fonctionnement de l'Agence aboutissait trop souvent à ce que le ministre de la santé était placé en première ligne en ce qui concerne la question du remboursement d'un médicament. L'Agence, en particulier la commission de la transparence, examine le dossier mais, lorsque la demande de remboursement ne lui paraît pas fondée, préfère souvent s'exonérer de toute responsabilité en la matière : le ministre est alors contraint de prendre la décision en lieu et place de l'AFSSAPS, dont c'est pourtant l'une des missions .
Interrogée sur ce point, l'Agence a réfuté ces arguments, indiquant que « les décisions relatives au remboursement sont de la compétence du ministre, après avis de la commission de la transparence et du CEPS 7 ( * ) . Les responsabilités de l'Agence sont donc en ce domaine relatives au secrétariat de la commission de la transparence : l'Agence doit s'assurer que la commission de la transparence examine les dossiers qui lui sont soumis par les firmes, dans le respect de la réglementation (code de la sécurité sociale, règlement intérieur de la commission) et transmettre ces avis au CEPS selon les procédures établies entre le secrétariat de l'Agence et celui du CEPS. De plus, les avis de la commission sont rendus publics sur le site de l'AFSSAPS. Ces avis contiennent les éléments prévus par la réglementation pour permettre au CEPS de rendre son avis et au ministre de prendre sa décision quant au remboursement des médicaments ainsi qu'à leur taux ».
Votre rapporteur partage cette analyse , estimant qu'il convient de s'en tenir à un partage clair des responsabilités : un établissement public chargé de missions techniques, même très importantes, ne saurait se substituer à une décision relevant du pouvoir politique.
2. L'expertise externe : le pari de la neutralité et de l'indépendance
Le système d'évaluation de l'AFSSAPS repose sur une expertise interne et une expertise externe, c'est-à-dire provenant de la communauté médicale et scientifique, qui sont complémentaires.
L'expertise externe doit reposer sur les principes d'indépendance et d'impartialité. A cet égard, il convient notamment de rappeler les dispositions de l'article 13 du décret du 28 novembre 1983, selon lesquelles « les membres d'un organisme consultatif ne peuvent prendre part aux délibérations lorsqu'ils ont un intérêt personnel à l'affaire qui en est l'objet. La violation de cette règle entraîne la nullité de la décision subséquente lorsqu'il n'est pas établi que la participation du, ou des membres intéressés, est restée sans influence sur la délibération ».
Or, les experts externes auxquels recourt l'Agence sont, le plus souvent, des médecins, libéraux ou hospitaliers, et des universitaires, qui collaborent plus ou moins régulièrement avec l'industrie pharmaceutique.
Comme le note le rapport 2001 de l'Agence sur les déclarations d'intérêts, « s'il n'existe donc pas d'incompatibilité de principe, des règles ont été fixées afin d'assurer la transparence sur ces liens. Cette transparence est fondamentale et garantit la qualité du processus décisionnel. Elle signifie que les décisions elles-mêmes soient justifiées et que, dans la mesure du possible, les informations sur lesquelles elles reposent soient accessibles au public ».
Afin de prévenir tout risque déontologique, l'AFSSAPS s'est dotée d'une cellule de veille déontologique , dirigée par un magistrat de l'ordre judiciaire, chargée de faire appliquer la réglementation en la matière et de la faire connaître.
Par ailleurs, au moment de leur nomination ou de leur entrée en fonction, ces experts, qui siègent au sein des commissions et conseils de l'Agence, ainsi que les experts et rapporteurs qui collaborent aux travaux des commissions, ont l'obligation de remplir, sur l'honneur, une déclaration publique d'intérêts mentionnant les liens, directs ou indirects, qu'ils peuvent avoir avec les entreprises ou établissements dont les produits entrent dans le champ de compétences de l'Agence, ainsi qu'avec les sociétés ou organismes de conseil qui interviennent dans ces secteurs.
Cette déclaration est rendue publique, sous la forme d'un rapport, et est régulièrement actualisée à l'initiative du déclarant dès qu'une modification intervient 8 ( * ) .
Doivent ainsi être déclarées au titre des intérêts :
- les participations financières dans le capital d'une entreprise ;
- les activités donnant lieu à une rémunération personnelle permanente (contrat de travail) ou ponctuelle (essais cliniques et travaux scientifiques, rapports d'expertise, activité de conseils, conférences, actions de formation...) ;
- les activités donnant lieu à un versement au budget d'une institution (établissement hospitalier, université, association).
D'autres situations peuvent, en outre, être déclarées, comme l'emploi d'un parent dans une entreprise du secteur pharmaceutique ou la participation au conseil d'administration ou au conseil scientifique d'une société.
Néanmoins, ces « bonnes intentions » se sont souvent heurtées aux faits. Ainsi, les rapports publics comme le site Internet de l'AFSSAPS ont longtemps été pauvres en informations scientifiques vraiment intéressantes pour les médecins, qui continuaient de préférer consulter le dictionnaire médical Vidal . De surcroît, si celui-ci est financé par les laboratoires pharmaceutiques privés, les notices qu'il contient sont rédigées, le plus souvent, par des membres de la commission d'AMM, évidemment rémunérés pour cette activité ! Le risque de conflit d'intérêt paraît donc manifeste. Pour la Cour des comptes, le système d'information médicale aurait probablement été plus simple - et plus sain - si l'AFSSAPS avait mis rapidement en ligne les avis de la commission d'AMM.
D. UNE TUTELLE DÉLICATE À EXERCER
1. Les modalités d'organisation de la tutelle sur l'AFSSAPS
a) Dans le domaine administratif et fonctionnel
La tutelle de l'Agence dans le domaine fonctionnel est exercée par la direction de l'administration générale, du personnel et du budget (DAGPB) du ministère de la santé, en fonction des axes de santé publique établis par la direction générale de la santé (DGS), chef de file de la tutelle santé. Toutefois ce schéma tend à être remis en cause avec l' éventualité d'une tutelle fonctionnelle passant à la DGS .
La coordination de la tutelle fonctionnelle passe par deux dispositifs principaux :
- un bureau pivot (BFCG4), au sein duquel a été récemment affecté un cadre supérieur pour les relations avec l'AFSSAPS. Le bureau assure notamment une interface avec le ministère du budget (et son bureau 6B) ;
- une réunion régulière des secrétaires généraux des agences. Ces réunions, organisées au départ à l'initiative des secrétaires généraux, se font à présent, régulièrement, sous la double coordination de la DGS et de la DAGPB. Ces réunions complètent les relations directes qui existent entre les agences et leurs directions générales et les services des ressources humaines.
Un travail important de réflexion sur les relations entre la tutelle et les agences a été conduit en 2002. Sa mise en oeuvre doit être finalisée. Cette réflexion a été menée par la DGS, en relation avec la DAGPB. L'AFSSAPS a participé aux différents groupes de travail et comités de pilotage. Des documents pratiques ont été établis avec le double principe du pilotage stratégique par l'administration centrale, et d'une autonomie d'activité sectorielle et de gestion de l'Agence, cohérente avec son statut d'établissement public administratif. À partir de ce travail, des outils de suivi partagés (tableaux de bord) doivent être implémentés. Ils permettront de faciliter le suivi sur la base de la répartition des rôles entre la DGS et la DAGPB.
|
Le recours à un prestataire extérieur pour adapter l'organisation de l'exercice de la tutelle Suite aux remarques de la Cour des comptes, la direction générale de la santé a fait appel à un prestataire extérieur, la société Eurogroup, pour la réflexion qu'elle avait engagée sur l'adaptation de l'organisation de l'exercice de sa tutelle sur l'ensemble des agences de sécurité sanitaire. Cette prestation, conduite en liaison avec la délégation interministérielle à la réforme de l'Etat (DIRE), a débuté en décembre 2001 pour s'achever en juillet 2002 : elle s'inscrivait donc dans un projet de réforme de l'Etat. Il s'agissait également de mieux contribuer à la mise en oeuvre de la politique de santé publique. D'après une note de la DGS et de la DAGPB du 3 avril 2002, il s'agit « de rationaliser et de professionnaliser l'exercice de la tutelle, de clarifier le rôle de chacun des intervenants, de concevoir des outils communs adaptés à la fonction de tutelle « stratégique » et, in fine , de renforcer la capacité de pilotage du ministère ». Selon la DGS, le déploiement du plan d'action livré par Eurogroup, et validé par la direction générale en juillet 2002, serait actuellement en cours. Un guide méthodologique a été élaboré et finalisé en novembre 2002, avant sa diffusion. |
Les situations sont contrastées selon les secteurs.
Pour les ressources humaines , les relations avec la tutelle laissent transparaître de forts contrastes entre :
- la gestion courante des fonctionnaires détachés pour laquelle il existe encore une réelle difficulté pour leur promotion. C'est, par exemple, le cas lors des concours extraordinaires pour lesquels les personnels des agences ne peuvent pas toujours concourir, ou lors du versement de primes spéciales pour l'installation en Ile-de-France, ou encore pour les actes de gestion courante dont les délais trop longs pénalisent les personnels détachés. Les difficultés de promotion des personnels fonctionnaires en poste dans les agences concernent également le personnel géré par la direction de l'administration générale et de la modernisation des services (DAGEMO), du secteur emploi. Il est à noter que ces difficultés ne concernent pas le corps des pharmaciens inspecteurs, pour lequel l'AFSSAPS est représentée en commission administrative paritaire ;
- une volonté de progresser, dont le meilleur reflet est l'effort très important déployé par la DAGPB pour la réforme des statuts 9 ( * ) . Aussi une chargée de mission, ancien directeur départemental des affaires sanitaires et sociales, a-t-elle été spécialement affectée à temps plein sur ce sujet. En relation directe avec le chef de service, elle a concouru à un dispositif qui a permis, avec l'ensemble des agences, d'aboutir à la parution du décret en mars 2003, après plus de deux ans de travail. Il est à souhaiter que la même configuration puisse être maintenue pour l'actuelle réforme des personnels fonctionnaires statutaires scientifiques de l'AFSSAPS, qui sont des fonctionnaires de l'Agence.
Dans le domaine budgétaire , l'implication de la DAGPB, qui était effective surtout lors de la préparation budgétaire et celle des décisions modificatives budgétaires, se renforce, avec une analyse en amont des moyens nécessaires, tant humains que financiers, qui se réalise lors de réunions de travail communes régulières. Ce travail permet à la tutelle d'être mieux à même d'intégrer les missions et les besoins de l'établissement dans le cadre général de l'allocation des moyens au niveau du ministère.
b) Dans le domaine scientifique et technique
En ce qui concerne les relations scientifiques , elles prennent différentes formes.
Tout d'abord, l'Agence est en relations suivies avec la DGS, et, en particulier, la sous-direction en charge des produits de santé, pour ce qui est de l'élaboration des textes applicables dans son champ de compétences. Les décrets d'application de la loi du 1 er juillet 1998 précitée, et la transposition en droit national des directives communautaires pertinentes, sont ainsi élaborés conjointement par la DGS et l'AFSSAPS, qui échangent sur leurs projets de textes respectifs 10 ( * ) .
L'Agence fournit globalement une expertise juridique et technique sur les points de réglementation applicable aux produits de santé. C'est le cas, par exemple, en ce qui concerne en ce moment la réforme de la loi de bioéthique, ou pour la transposition de la directive européenne relative aux essais cliniques.
L'Agence met ensuite en oeuvre la réglementation, en rendant compte de son activité à la DGS, sur le répertoire des médicaments génériques notamment. L'Agence fait part à sa tutelle des difficultés rencontrées dans le cadre de l'exercice de ses missions, en proposant, le cas échéant, des modifications législatives ou réglementaires qui sont expertisées par la tutelle.
En outre, l'Agence est fréquemment saisie pour fournir des renseignements sur différents médicaments, dispositifs médicaux ou cosmétiques, tant sur leur rapport bénéfice/risque que sur leur pharmacovigilance ou leur bon usage ou pour qualifier juridiquement des produits. Le directeur général de l'Agence est membre de la conférence nationale de sécurité sanitaire et participe aux rencontres bimensuelles de sécurité sanitaire sous l'égide du directeur général de la santé.
Par ailleurs, l'Agence est associée aux différents volets des politiques de santé publique et d'organisation des soins qui concernent les produits de santé. Elle participe ainsi, avec la DGS, à la promotion des médicaments orphelins et pédiatriques, au reclassement des médicaments actuellement rétrocédés par les hôpitaux, ainsi qu'à des réflexions générales sur le développement de l'automédication ou l'évolution du système de distribution pharmaceutique.
c) Des relations indirectes mais importantes avec les deux autres ministères de tutelle
Les relations avec la direction du budget du ministère des finances se font essentiellement par l'intermédiaire de la DAGBP et du contrôleur financier, représentant du ministère des finances au sein de l'établissement. Celles-ci sont complétées, selon les besoins, par des demandes d'information de la direction du budget. Dans ce cas, les réponses sont bien évidemment retransmises aux tutelles du secteur santé. La DAGPB a renforcé son implication et, en particulier, son rôle d'interface avec la direction du budget.
La direction générale de l'administration et de la fonction publique (DGAFP) est également sollicitée, en relation avec la DAGPB ou en direct, sur certaines questions pratiques statuaires.
2. Un exercice imparfait de la tutelle
D'une manière générale, les modalités de l'organisation et du fonctionnement de la tutelle de la DGS, mais aussi de celle de la direction de la DAGPB pour les questions budgétaires, ne sont pas très satisfaisantes.
L'exercice de la tutelle de la DGS sur l'Agence est aujourd'hui délicat, la direction générale de la santé ayant l'impression d'avoir perdu en expertise scientifique depuis la création de l'AFSSAPS.
Toutefois, selon les inspections générales de finances et des affaires sociales, les responsabilités sont partagées.
L'Agence n'a présenté à la DGS ni axes prioritaires d'actions ni objectifs hiérarchisés à poursuivre. Il était dès lors difficile pour l'administration centrale de contrôler des priorités qui n'existaient pas ! Il convient à cet égard de souligner que l'Agence ne s'est pas suffisamment appuyée sur son conseil scientifique pour définir ses priorités et ses objectifs.
En outre, la DGS, et à travers elle le ministre, devrait être associée davantage en amont sur les impératifs de santé publique, puis recevoir des informations plus complètes, sans nécessairement disposer d'un pouvoir de vote, pour ne pas être influencée au moment de la prise de décision sur les conditions du remboursement du prix des médicaments ou sur les volumes et populations concernés par une prescription, ces éléments ayant d'évidentes conséquences sur la façon dont les entreprises vont produire les médicaments. Le ministre de la santé doit pouvoir se trouver dans une position d'indépendance par rapport aux avis de la commission de la transparence.
Or, la DGS, comme la direction de la sécurité sociale (DSS), siègent à la commission de la transparence, qui est placée auprès du ministre de la santé, et dont le secrétariat, rappelons-le, est assuré par l'AFSSAPS. Elle participe également aux travaux du CEPS, où sont discutés les prix des médicaments.
Une telle situation n'est indéniablement pas satisfaisante, puisque la DGS est à la fois juge et partie. Il conviendrait par conséquent de mettre un terme à son droit de vote - ainsi qu'à celui de la DSS - à la commission de transparence comme au CEPS.
D'autre part, la Cour des comptes a rappelé que la DGS avait souhaité mettre en place une « tutelle stratégique » mais qu'elle n'y était pas parvenue. Elle essaie désormais de récupérer l'intégralité de la tutelle, la DAGPB n'étant pas hostile à cette perspective. Si la tutelle sur l'Agence se renforce progressivement, elle n'est pas encore pleinement établie, d'autant plus que la DGS manquerait de moyens pour exercer pleinement ses missions de tutelle. Annoncé depuis la fin 1999, le contrat d'objectifs et de moyens n'est toujours pas conclu 11 ( * ) .
Enfin, les relations entre la DGS et l'Agence n'ont pas toujours été bonnes, ce qui a amené l'Agence à entretenir des relations directes avec le cabinet du ministre, rendant plus compliqué encore l'exercice de la tutelle. Ainsi, le premier directeur général de l'Agence était M. Didier Tabuteau, qui avait été le directeur de cabinet de M. Bernard Kouchner, ministre délégué à la santé dans le précédent gouvernement. Cette situation n'a pas manqué de poser des problèmes à la DGS, qui s'est trouvée, de facto , « court-circuitée » par le cabinet du ministre !
L'Agence souffre d'un indéniable problème de positionnement . Si la DGS s'est dessaisie de certaines de ses compétences, en particulier d'importants pouvoirs de police sanitaire, au profit d'une agence qui intervient par délégation directe du ministre, l'administration centrale n'a pas encore tout à fait intégré cette situation.
Etablir un parallélisme entre le système français et le système américain paraît erroné. Aux Etats-Unis, les agences ont des compétences administratives, alors qu'en France, elles existent à côté de l'administration. Cette coexistence a engendré un système très complexe et parfois antinomique, ainsi lorsque l'AFSSAPS et l'Agence nationale d'accréditation et d'évaluation en santé (ANAES) ont émis des recommandations contradictoires sur les mêmes traitements hypocholestérolémiants ! Or, la DGS n'a pas su arbitrer cette difficulté d'harmonisation.
II. UNE AGENCE CONFRONTÉE À DES PROBLÈMES DE CROISSANCE
A. LES MOYENS DE L'AGENCE : UNE CROISSANCE PLUS RAPIDE QUE SA CAPACITÉ À LES METTRE EN OEUVRE
Le budget de l'AFSSAPS a considérablement augmenté, car il a constitué, comme l'ensemble des agences de sécurité sanitaire, une priorité budgétaire. L'AFSSAPS a néanmoins fini par accumuler une trésorerie considérable, d'un montant supérieur à 47 millions d'euros début 2001.
D'une manière générale, l'Agence présente une situation paradoxale : son budget et ses effectifs sont devenus très conséquents, alors que sa structure administrative est demeurée faible. En effet, l'Agence a longtemps été sous-gérée sur le plan administratif, en raison des impératifs de sa mise en place rapide et de la priorité donnée aux aspects scientifiques de ses missions.
Il faut y voir une source de fragilité pour l'exercice par l'AFSSAPS de ses missions.
1. L'AFSSAPS, une priorité budgétaire...
a) La forte croissance des moyens budgétaires de l'Agence
Les agences de sécurité sanitaire ont constitué une priorité budgétaire au cours des dernières années, comme le montre la forte progression des dépenses de l'AFSSAPS depuis 1999 :
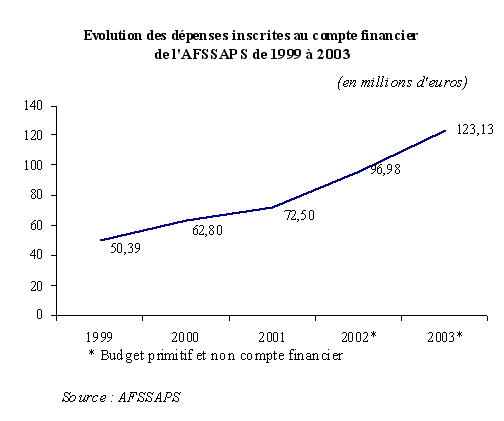
Ainsi, sur trois exercices, entre 1999 et 2001, les dépenses de l'AFSSAPS ont crû de 43,9 %, à 72,5 millions d'euros en 2001 , ce qui correspond à une montée en charge très rapide de l'Agence.
Si l'on s'en tient aux prévisions des budgets primitifs 2002 et 2003, les dépenses de l'Agence devraient même s'établir à près de 97 millions d'euros en 2002 et 123,13 millions d'euros en 2003. Ainsi, depuis 1999, ses dépenses auraient augmenté de 144,4 %, et d'environ 27 % sur un seul exercice, entre 2002 et 2003 !
Toutefois, votre rapporteur tient à souligner la surestimation systématique des dépenses de l'Agence dans le budget primitif . En réalité, les écarts entre les dépenses inscrites au budget primitif et les dépenses constatées au compte financier sont très substantiels, même s'ils ont tendance à se réduire :
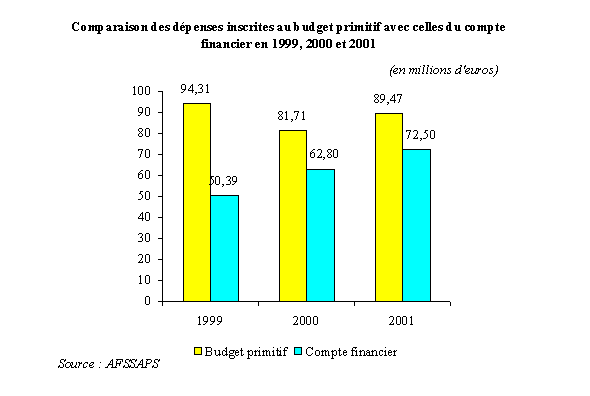
Il est donc très probable que les dépenses constatées en 2002 et 2003 seront inférieures aux dépenses prévues.
b) Les recettes : une subvention de l'Etat nécessaire à l'équilibre financier de l'Agence ?
Quant aux recettes de l'AFSSAPS, elles ont connu une évolution erratique, l'année 2002 venant rompre la tendance à la hausse régulière, le montant des recettes diminuant de plus de 10 millions d'euros entre 2001 et 2002, soit - 11,6 %.
Cette évolution tient à la diminution de la subvention versée par l'Etat à l'AFSSAPS, du fait des différentes mesures de régulation budgétaire intervenues en 2002.

Par ailleurs, il convient de souligner l'importance de la part des taxes, droits et redevances parmi ses recettes de fonctionnement, toujours supérieure à 50 % depuis l'origine, et qui augmente même puisqu'elle devrait s'établir à 82 % en 2003 :

L'Etat verse une subvention d'exploitation à l'AFSSAPS , inscrite sur le chapitre 36-81, article 11, du budget de la santé. Son montant et sa part au sein des recettes de fonctionnement de l'établissement ont évolué de la manière suivante :
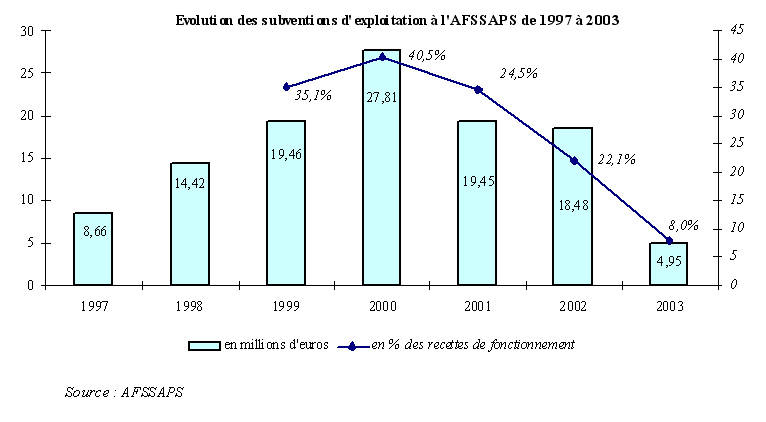
Il est évidemment frappant de constater que, depuis l'exercice 2000, la subvention du budget de l'Etat ne cesse de diminuer . A cette date, elle représentait 27,81 millions d'euros, soit 40,5 % des recettes de fonctionnement de l'Agence, contre seulement 4,95 millions d'euros en 2003 et 8 % de ses recettes de fonctionnement.
La diminution de la subvention, en pourcentage des recettes, en 2001 et 2002, est liée à la mise en place des taxes sur les dispositifs médicaux. En 2002, l'établissement a, par ailleurs, fait l'objet d'une mesure de régulation budgétaire portant sur 7 millions d'euros. En 2003, « le niveau particulièrement bas de la subvention s'explique par la volonté des tutelles d'assécher le fonds de roulement de l'établissement », dont on verra plus loin qu'il est effectivement demeuré longtemps trop élevé.
Or, ce mouvement n'est pas seulement lié à des raisons conjoncturelles - la situation délicate des finances publiques françaises. Il résulte aussi d'une interrogation de fond sur la véritable utilité d'une telle subvention pour l'équilibre financier de l'Agence .
Du reste, le taux de consommation des crédits est parfois peu important, ce qui donne lieu à de substantiels reports. Cette sous-consommation résulte d'ailleurs, en partie, de la non publication des décrets d'application relatifs aux nouvelles missions de l'Agence (cf. infra ).
Le tableau ci-dessous illustre cette situation :

Si le taux de consommation des crédits de fonctionnement de l'Agence s'est amélioré entre 1999 et 2002, passant de 83 % à 89 %, après un taux atteignant 92 % en 2001, et une moyenne de moins de 87 % au cours de ces quatre exercices, celui des dépenses d'investissement reste peu élevé, oscillant entre 60 % en 2000 et 83 % en 2001, avec un taux de consommation moyen de 68 %. La direction générale de l'Agence a estimé qu'il était « nécessaire d'apprécier ces résultats au regard de la montée en charge des missions de l'établissement ».
Néanmoins, cette situation conduit, une fois encore, à s'interroger sur la nécessité du versement d'une subvention en provenance du budget de l'Etat.
2. Des outils de gestion encore frustes
La tutelle budgétaire de l'AFSSAPS est exercée à la fois par la direction du budget du ministère de l'économie, des finances et de l'industrie et par la direction de l'administration générale, du personnel et du budget (DAGPB) du ministère des affaires sociales, du travail et de la solidarité.
Son exercice soulève néanmoins certaines interrogations, en raison de la situation, qualifiée par l'IGF et l'IGAS de « sinistrée », de la direction de l'administration et des finances de l'AFSSAPS. Celle-ci n'utilisait aucune procédure écrite pour élaborer le budget de l'Agence, en coordination avec les autres directions de l'établissement. En mai 2002, n'existait toujours aucune procédure budgétaire ni comptabilité analytique.
Interrogée sur ces points, l'AFSSAPS a contesté l'analyse des deux inspections générales, estimant que « les observations de l'IGF et de l'IGAS ne sont pas exactes ». Elle a fourni à votre rapporteur de nombreuses pièces, dont les plus anciennes concernent la préparation du budget primitif de 1997 de ce qui n'était encore que l'Agence du médicament, et qui témoignent effectivement de l'existence d'une procédure budgétaire formalisée au sein des services de l'Agence, tout au moins davantage que ce que l'IGF et l'IGAS ont laissé entendre.
|
L'organisation de la procédure budgétaire L'organisation de la procédure budgétaire depuis 1995 à ce jour s'est effectuée de la manière suivante. Dès le premier trimestre, préparation des demandes de financement tant en reconduction qu'en mesures nouvelles dans le cadre de la loi de finances et plus particulièrement sur la subvention d'Etat attribuée à l'établissement. Vers la fin du second trimestre et sous l'égide de la direction générale, une lettre est adressée à chaque directeur afin de recueillir l'ensemble des besoins budgétaires tant en emplois qu'en subventions et moyens logistiques. Cette lettre était accompagnée d'une procédure et d'un tableau type. Parallèlement à cet envoi, les services financiers de l'établissement sur le constat des six premiers mois de consommation établissent la base budgétaire de reconduction. Durant le troisième trimestre, il est présenté à la direction générale le traitement financier de l'ensemble des demandes des directions opérationnelles pour un premier arbitrage. Au lendemain de ce dernier, les discussions s'engagent avec les différentes tutelles sur la détermination des moyens de reconduction ainsi que des mesures nouvelles, ceci afin d'établir le budget primitif et de le présenter aux différentes instances de l'établissement. Dans le dernier trimestre et au lendemain de l'approbation budgétaire, les services financiers installent le budget ainsi approuvé en déterminant à la fois les enveloppes octroyées aux différents sites et les enveloppes affectées aux différentes directions opérationnelles. Cette procédure a été appliquée jusqu'à l'exercice 2001. Pour ce qui est de 2002, le changement de logiciel comptable a nécessité une période d'adaptation (qui n'a pas permis de maintenir cet objectif). Après l'obtention du visa budgétaire du contrôleur financier, la politique du niveau d'ouverture des crédits est définie en étroite collaboration avec l'agent comptable et le contrôleur financier. Parallèlement à cette étape, la direction générale opère un ultime arbitrage pour redéfinir les moyens attribués à chaque directeur. Pour cette dernière étape, l'arbitrage se situe essentiellement sur l'attribution des créations de postes obtenues. Une notification à chaque directeur, du budget ainsi consolidé, est transmise. Ensuite, lors du déroulement de l'exécution dudit budget, un tableau de bord sur l'état des consommations est mensuellement adressé aux différentes directions. Source : réponse de l'AFSSAPS à une question de votre rapporteur |
En tout état de cause, selon des informations communiquées à votre rapporteur par l'IGF et l'IGAS, « la politique des achats a été totalement bloquée », entre le 26 octobre 2001 et le mois de mars 2002.
L'AFSSAPS, dans sa réponse, cherche à minimiser cet incident, qui serait dû, selon elle :
- aux contraintes administratives qui lui ont été imposées : « en préalable aux éléments de réponse plus précis sur la politique d'achats, il convient de rappeler que l'établissement a dû faire face à de nombreux changements de ses moyens de gestion (passage à l'euro, changement du logiciel comptable qui a induit une nécessité d'adaptation des personnels utilisateurs et l'application du nouveau code des marchés publics, et plus particulièrement la mise en place des codes de nomenclature dont la parution datait du 26 décembre 2002 et dont l'application devait prendre effet à compter du 1 er janvier 2003) » ;
- aux délais inhérents à la procédure budgétaire : « cette procédure [budgétaire] fait effectivement intervenir des délais minimum d'environ un mois entre les exercices consécutifs d'une année à l'autre. De ce fait, la politique d'achats de l'établissement a été suspendue entre la fin de l'exercice 2001 et le début de l'exercice 2002, ce qui représente une période d'une durée d'un mois, avec cependant des mesures conservatoires pour répondre aux urgences (lettres d'intention de commande). En effet, le dernier bon de commande pris en charge sur 2001 datait du 20 décembre. Le premier bon de commande 2002 a quant à lui été signé le 12 février. Seul le mois de janvier n'a pas permis d'engagement de dépenses, la raison de ce décalage étant à imputer aux délais d'exécution du budget. En effet, il est à noter que le budget primitif 2002 a été soumis aux instances le 14 décembre 2001, suivi d'une approbation expresse le 21 décembre. La demande d'ouverture des crédits permettant l'exécution dudit budget n'est intervenue que le 14 janvier 2002, et a été visée par le contrôleur financier le 30 janvier 2002 ».
Néanmoins, au-delà de ces dysfonctionnements techniques, il existe, au sein de l'Agence, un réel problème lié à l'absence de contrôle de gestion et, par conséquent, de capacité d'évaluer avec précision les activités de l'Agence au regard d'indicateurs de performances solidement établis 12 ( * ) .
Cette situation a d'ailleurs amené certains membres du conseil d'administration à intervenir publiquement, pour s'en inquiéter.
Ainsi, au cours de la réunion du conseil d'administration du 7 juin 2001, la représentante du directeur général de la santé, en charge de la tutelle de l'Agence, « déclare qu'il est nécessaire de clarifier les missions de l'AFSSAPS telles que définies par la loi ». « Elle reconnaît [...] que certaines actions doivent être financées alors même qu'elles n'avaient pas été programmées ». Elle a également mentionné « la nécessaire mise en place d'un renforcement d'une évaluation des prestations fournies en regard des crédits versés ».
Cet indispensable effort de programmation et d'évaluation devrait se concrétiser au travers de la signature d'un contrat d'objectifs et de moyens entre l'Etat et l'Agence. Or, il convient de constater un retard par rapport à la procédure initialement prévue, qui, d'après l'Agence, serait indépendant de sa volonté : « l'audit IGF/IGAS s'est terminé en décembre 2002. Les conclusions définitives sont en attente à ce jour (juillet 2003) 13 ( * ) ».
B. L'EMPLOI PERFECTIBLE DES MOYENS DE L'AGENCE
1. La constitution d'un confortable « matelas » de trésorerie injustifié
Le fonds de roulement de l'Agence a évolué de la manière suivante, entre 1999 et 2002 :
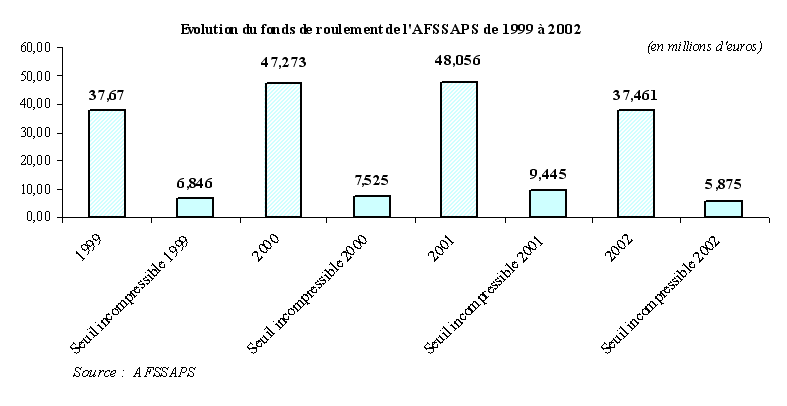
Ce fonds de roulement a, au cours des trois premières années d'existence de l'AFSSAPS, substantiellement augmenté, passant de 37,67 millions d'euros en 1999 à 48,06 millions d'euros en 2001, soit une progression de 27,6 %. L'essentiel de cette augmentation a pu être constatée entre 1999 et 2000 : le fonds de roulement a alors crû de près de 10 millions d'euros, soit + 25,5 %.
Ce niveau représentait 5,5 fois le montant du seuil incompressible du fonds de roulement en 1999, 6,3 fois son montant en 2000, 5,1 fois en 2001 et 6,4 fois en 2002. L'AFSSAPS avait fini par se constituer de considérables réserves.
Comme l'a elle-même relevé la direction générale de l'établissement, « ce fonds de roulement [...] pourrait paraître élevé . Il « était destiné à autofinancer différents programmes immobiliers tels que la construction d'un immeuble à Saint-Denis, l'achat d'un bâtiment en location à Saint-Denis, l'extension des laboratoires de Lyon et de Vendargues ainsi que la construction d'un immeuble d'archives à Vendargues ».
Or, les ambitions immobilières de l'Agence ont été contrariées, en grande partie en raison des carences de ses propres services administratifs et juridiques, et ont dû être, sinon abandonnées, du moins repoussées à une échéance inconnue. L'IGF et l'IGAS ont d'ailleurs indiqué à votre rapporteur que « toute la politique immobilière de l'Agence est à revoir » 14 ( * ) !
|
Une politique immobilière ambitieuse mais velléitaire L'AFSSAPS a eu des projets immobiliers importants, visant notamment à construire un immeuble à Saint-Denis, et avait reçu l'accord de sa tutelle. Pourtant, selon des informations communiquées à votre rapporteur par l'IGF et l'IGAS, le projet était « vide », ne comportant aucune définition des besoins. Le 1 er août 2001, la commission supérieure des marchés a d'ailleurs émis un avis défavorable sur ce projet, qui a alors été ajourné 15 ( * ) . Par ailleurs, si un bail de location a été conclu en mars 2003, il ne comporte aucune clause de sortie au cours des neuf années suivantes. Le coût de la location et du déménagement n'avait pas été chiffré par l'Agence, mais les deux inspections générales l'ont estimé à 6 millions d'euros sur quatre ans. Elles ont également estimé que, si le nouvel immeuble avait été construit, l'Agence aurait disposé de trop de surfaces . Interrogée sur ces points, ainsi que sur celui du recours à l'emprunt pour acheter un immeuble à Saint-Denis, l'Agence a apporté les réponses suivantes, du reste plus ou moins convaincantes : « Sur le choix du bâtiment : l'Agence, engagée sur la base d'un bail à 9 ans fermes, s'est vue contrainte par la déficience de son propriétaire (perte du statut de locataire en sous-locataire) et cela au lendemain du lancement du programme de réimplantation des laboratoires (4,8 millions d'euros), d'analyser les différentes possibilités pour la sauvegarde de ses intérêts. Après une analyse juridique soumise aux différentes tutelles, et plus particulièrement au service judiciaire du Trésor, il est apparu que l'acquisition, soit directe soit en crédit bail, permettait de sauvegarder les intérêts contractuels de l'établissement. Cette situation explique pourquoi l'Agence est devenue propriétaire de ses locaux. « Pourquoi le non recours à un autofinancement : [...] les fonds propres de l'établissement détenus au 31 décembre 1996 étaient insuffisants au regard du montant à investir (18,90 millions d'euros). « Pourquoi le recours à l'emprunt : la position de la direction du budget, face à cette situation imprévisible, était que l'établissement ait recours à un emprunt en totalité avec pour condition que les charges de remboursement dudit emprunt correspondent aux loyers supportés par l'établissement. Sur ces bases, et au lendemain d'un appel d'offre informel, seule la solution d'un financement sur une durée de 20 ans a pu être retenue. Par ailleurs, il faut noter que l'établissement était engagé par son conseil d'administration sur la réimplantation de ses trois laboratoires (Saint-Denis, Lyon, Montpellier) et que les réserves constituées en fonds de roulement devaient permettre d'effectuer ces réimplantations en autofinancement. Il est permis de constater que tel fut le cas ». |
La direction générale a également précisé que, « en 2002, l'établissement a réalisé pour partie sa programmation immobilière par l'acquisition d'un bâtiment à Saint-Denis et le lancement de l'extension des laboratoires de Lyon et a effectué les différentes régulations budgétaires par prélèvement sur les richesses constituées 16 ( * ) . Ce fonds de roulement fin 2002 était ramené à 37,461 millions d'euros ».
Cette information est riche d'enseignements. Elle illustre en effet le niveau trop élevé des réserves de trésorerie de l'Agence, qui ont en réalité servi à absorber les opérations de régulation budgétaire, ainsi que la façon dont l'Agence perçoit ses réserves ou, plutôt, ses « richesses »...
En 2003, « la nécessité d'un prélèvement de 32,18 millions d'euros pour le respect des équilibres compte tenu de la baisse de la subvention, a contraint l'établissement à recourir à des financements extérieurs pour assurer son programme immobilier ». Les réserves de l'AFSSAPS ont donc, une nouvelle fois, été mises à contribution par le biais d'un prélèvement, au titre de ce que les bureaux ministériels appellent la « valorisation » de trésorerie 17 ( * ) .
Ainsi, « ce fonds de roulement prévisionnel fin 2003 devrait se situer autour de 6 millions d'euros, soit un mois d'activité ».
Il paraît de meilleure gestion de ramener le fonds de roulement de l'Agence à un niveau plus raisonnable, les établissements publics n'ayant pas à se constituer de telles réserves de trésorerie.
Enfin, il convient de souligner que le seuil incompressible du fonds de roulement est passé de deux mois d'activité entre 1999 et 2002 à un mois à partir de 2003. Ce qui était « incompressible » un jour ne l'est plus nécessairement le lendemain...
Votre rapporteur croit néanmoins que l'aisance financière de l'AFSSAPS a pu, en partie, expliquer l'absence de comptabilité analytique en son sein, lui faisant négliger les réformes à entreprendre pour atteindre une réelle performance dans sa gestion.
2. La forte augmentation des effectifs de l'AFSSAPS
L'AFSSAPS a été constituée en termes de moyens humains sur la base de ceux dont était dotée l'Agence du médicament pour les compétences qui lui étaient confiées en matière de médicament et de réactifs de laboratoires.
Son champ de compétences s'étant beaucoup étendu, l'Agence a fait l'objet d'importants efforts de la part des pouvoirs publics en termes de créations d'emplois.
Au 31 décembre 2002, les effectifs théoriques de l'Agence s'élevaient à 931, soit 204 agents de plus qu'en 1999, première année de son fonctionnement effectif, + 28,1 % en quatre ans. Comparativement à 1998, dernière année d'existence de l'ancienne Agence du médicament, les effectifs de l'AFSSAPS ont crû de plus de 300 personnes, en hausse de 48,2 % en cinq ans.

Ce sont les personnels contractuels qui ont connu la progression la plus importante depuis 1999, voyant leur nombre passer de 537 en 1999 à 736 en 2002, soit une hausse de 37,1 %. En 2002, les contractuels représentaient un peu plus de 79 % des effectifs de l'Agence, contre 73,9 % en 1999. Ils ne constituaient que 59 % des effectifs de l'ancienne Agence du médicament, en 1997.
En 2002, l'Agence a bénéficié de 22 créations d'emplois destinées à renforcer ses activités administratives et de soutien, dont 16 postes dans les services « support » - affaires financières, ressources humaines, affaires juridiques, systèmes d'information - et 6 postes de soutien administratif (développement de méthodes, correspondants administratifs...) au sein des directions scientifiques et techniques, tandis que 27 postes de type scientifique et technique étaient créés.
|
Les agents permanents et non permanents de l'AFSSAPS et leur répartition au 31 décembre 2001 Au 31 décembre 2001, l'AFSSAPS comptait 934 agents, dont 850 agents permanents et 84 agents non permanents (soit 9 % de l'effectif total). La distinction entre personnel permanent et non permanent se définit de la manière suivante : Le personnel permanent se définit comme l'ensemble des agents qui occupent un poste budgétaire ou qui est recruté pour compenser les rompus de temps partiels : - le personnel contractuel sous contrat à durée indéterminée (CDI) ; - le personnel contractuel sous contrat à durée déterminée (CDD) ; - les fonctionnaires détachés sur contrat de droit public ; - le personnel mis à disposition (MAD) 18 ( * ) ; - les personnels scientifiques et techniques de laboratoire ; - les pharmaciens inspecteurs de santé publique. Contrairement au personnel permanent, les agents non permanents n'occupent pas de poste budgétaire : - les agents occasionnels recrutés sous CDD ne pouvant excéder 10 mois consécutifs dans l'année ; - les agents sous contrats emploi consolidé (CEC) ; - les agents sous contrats emploi solidarité (CES) ; - les agents vacataires ; - les internes en pharmacie et en médecine ; - les agents saisonniers. Au 31 décembre 2001, les 882 emplois budgétaires se répartissaient de la manière suivante : Emplois fonctionnels 9 Titulaires administratifs 3 Pharmaciens inspecteurs de santé publique 26 Personnels scientifiques de laboratoire 74 Personnels techniques de laboratoire 83 Personnels contractuels 687 Total 882 1) Les personnels permanents Les personnels permanents comprennent 850 agents répartis selon la typologie suivante : Les personnels contractuels 19 ( * ) 697 Personnel contractuel sous CDI 555 Personnel contractuel sous CDD 86 Fonctionnaires détachés 52 Personnel mis à disposition 4 Les personnels fonctionnaires 20 ( * ) 153 Personnels scientifiques et techniques de laboratoire 131 Pharmaciens inspecteurs de santé publique 22 La part des personnels contractuels à l'AFSSAPS représente 82 % de l'effectif permanent. 2) Les personnels non permanents Le personnel contractuel non permanent comprend 84 agents répartis suivant la typologie suivante : Personnel contractuel sous contrat occasionnel 40 Agents sous contrat emploi consolidé (CEC) 30 Agents sous contrat emploi solidarité (CES) 9 Vacataires 5 Total 84 Source : AFSSAPS - Bilan social 2001 |
Pour avoir une image fidèle des moyens en personnels dont dispose l'Agence, il est néanmoins nécessaire de considérer ses effectifs réels, tant il est vrai que les écarts entre effectifs théoriques et réels peuvent parfois être importants .
|
Effectifs réels au 31 décembre de
l'année n de l'Agence du médicament
|
||||||
|
Directions |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
|
DEMEB (médicaments et produits biologiques) |
163 |
167 |
197 |
240 |
249 |
254 |
|
DEDIM (dispositifs médicaux) |
64 |
68 |
77 |
80 |
||
|
DEMEIS (évaluation médico-économique) |
44 |
45 |
51 |
62 |
69 |
70 |
|
DLC (laboratoires et contrôles) |
182 |
182 |
154 |
170 |
190 |
188 |
|
DIE (inspection) |
55 |
62 |
79 |
96 |
109 |
108 |
|
DASI (administration et informatique) |
76 |
79 |
94 |
96 |
97 |
104 |
|
Directions (y compris agence comptable) |
21 |
23 |
36 |
51 |
59 |
63 |
|
TOTAL |
541 |
558 |
675 |
783 |
850 |
867 |
|
Source : AFSSAPS |
||||||
Ainsi, au 31 décembre 2002, l'AFSSAPS disposait effectivement de 867 agents, au lieu de 931 effectifs théoriques, soit un taux de vacances de postes de 6,9 %. Ce taux de vacances, mise à part l'année 2001, où il n'était que de 3,6 %, tourne autour de 7 %, soit environ une cinquantaine à une soixantaine de postes inoccupés chaque année depuis la création de l'Agence.
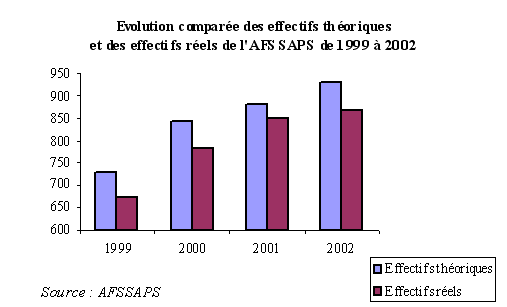
En 2002, les effectifs réels de l'Agence se répartissaient selon les directions de la manière suivante :
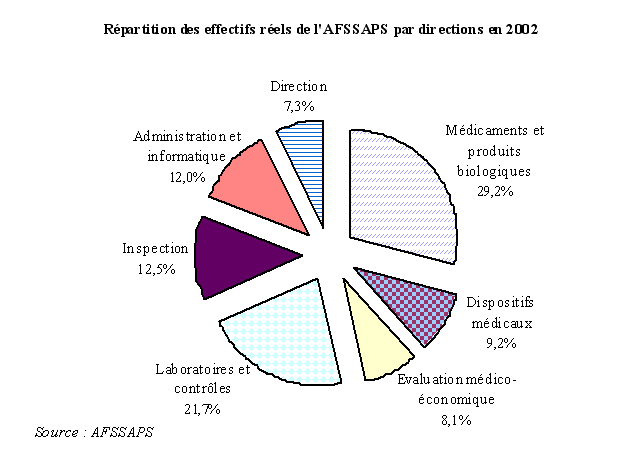
La direction des médicaments et produits biologiques est celle qui comprend les effectifs les plus importants, avec plus de 29 % des agents de l'AFSSAPS. Le nombre de ses personnels a augmenté de 52 % depuis 1998, moins toutefois que celui des agents de la direction de l'évaluation médico-économique, soit + 56 %, ou que celui des agents de l'inspection, avec + 74 % sur cinq ans.
Les personnels de l'Agence présentent des taux de rotation, ou turn over , relativement importants , bien qu'en nette décroissance : 21,4 % en 1999, 13,8 % en 2000, 7,6 % en 2001 et 6,4 % en 2002. Ces chiffres illustrent les difficultés de recrutement auxquelles elle est confrontée. Le recrutement de cadres scientifiques maîtrisant un domaine pointu ou acceptant des responsabilités d'encadrement nécessitait systématiquement, jusqu'au décret du 7 mars 2003, une dérogation au cadre de gestion défini pour les personnels de l'ancienne Agence du médicament. En outre, il existe d'importants écarts de rémunération entre les établissements publics relevant de la sphère sanitaire, au détriment de l'AFSSAPS, et les disparités de rémunérations des personnels contractuels et fonctionnaires de l'établissement avec des corps comparables du ministère de la santé.
Si le taux de départ des personnels contractuels de l'établissement reste normal par rapport aux moyennes constatées dans des structures comparables, soit autour de 5 % sur la période 1999-2001, il convient toutefois de noter qu'il touche plus particulièrement les personnels appartenant aux catégories d'emploi des médecins, pharmaciens et, depuis 2000, certains ingénieurs. Les démissions de ces types de personnels s'élèvent à 9 en 1999, 13 en 2000 et 27 en 2001. Ainsi, depuis quelques années, l'effort de recrutement de l'AFSSAPS se concentre de plus en plus sur le remplacement d'agents démissionnaires plutôt que sur l'intégration de nouveaux profils liés aux créations de postes. Enfin, entre le 1 er janvier et le 15 juillet 2002, une augmentation des démissions a pu être notée : 47 agents avaient quitté leurs fonctions au cours de ces quelques mois, dont 9 chefs d'unité ou de département, leur remplacement nécessitant des procédures dérogatoires aux dispositions communes, qui ont dû être négociées avec le contrôle financier. Pour mémoire, 8 chefs d'unité ou de département avaient quitté l'Agence en 2000 et 6 en 2001.
Parmi les raisons invoquées pour expliquer cette situation, la lenteur de la réforme statutaire a longtemps été avancée, les personnels de l'établissement ayant attendu environ trois ans que leur situation soit révisée 21 ( * ) .
3. Des critères d'attribution de subventions pas toujours bien établis
L'article R. 793-2 du code de la santé publique donne à l'AFSSAPS la possibilité d'attribuer des subventions sur son budget.
Toute demande de financement en vue d'un projet de recherche ou d'étude entrant dans le champ de compétences de l'Agence et présentant un intérêt scientifique fait l'objet d'un examen scientifique et technique par les directions de l'Agence. Il est ensuite procédé à un examen de la faisabilité budgétaire et comptable mais aussi à un examen juridique du contenu de la subvention. La demande est ensuite examinée par le conseil scientifique, qui émet un avis, mais c'est le conseil d'administration seul qui prend la décision.
Dans son relevé de constatations définitives sur la mise en place de l'AFSSAPS, du 25 février 2003, la Cour des comptes notait que « l'Agence dispose d'une très grande latitude pour accorder des subventions ou signer des conventions » et que ces subventions « sont décidées librement par l'AFSSAPS ».
Or, ces dépenses atteignent un niveau non négligeable, qui représentait 8,5 % des dépenses de fonctionnement en 2000, 6,7 % en 2001 et 5,9 % en 2002.
Le montant de ces subventions a évolué de la manière suivante depuis 1999 :
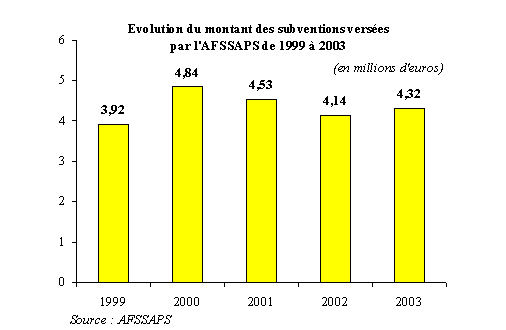
Les subventions allouées par l'Agence le sont à différents titres, et leur répartition est retracée dans le tableau ci-dessous :

Il convient de préciser que les rubriques « pharmacodépendance » et « pharmacovigilance » correspondent au versement de subventions, non à des associations stricto sensu , mais à des établissements hospitaliers, en particulier des centres hospitalo-universitaires (CHU), dans le cadre d'engagements pluriannuels. Néanmoins, au-delà de ces engagements, le conseil d'administration est libre de leur allouer une subvention d'un montant de son choix.
Il a paru à l'Agence indispensable de réaliser un audit sur l'activité des centres de pharmacovigilance (CRPV) qu'elle subventionne, mais la conduite de cet audit, selon la Cour des comptes, a pris du retard. L'Agence, interrogée sur ce point par votre rapporteur, a indiqué que, « par note du 8 novembre 2002, la direction de l'évaluation des médicaments et des produits biologiques a présenté au directeur général le cadre dans lequel se situaient les relations financières entre l'Agence et les CRPV et plus particulièrement leurs modalités de financement. De surcroît, au vu des bilans financiers des différents CRPV pour les années 1999 à 2001, il a été proposé une démarche de gestion des reliquats ».
L'AFSSAPS alloue une part croissante de ses subventions à ces deux secteurs, qui représentaient 53,3 % du total en 1999 mais 67,7 % en 2003. Si la rubrique « autres subventions » voit sa part nettement diminuer sur la même période, elle demeure un intitulé trop vague au regard des sommes en jeu - encore près de 850.000 euros en 2003 22 ( * ) .
L'attribution de subventions donne lieu, régulièrement à des débats nourris au sein du conseil d'administration, plusieurs intervenants soulignant les limites des critères d'attribution.
Ainsi, au cours de la séance du conseil d'administration du 7 juin 2001, le débat a notamment porté sur le versement de subventions aux centres d'évaluation et d'information sur les pharmacodépendances (CIEP), qui étudient les usages abusifs ou détournés des médicaments ou bien encore les dépendances qu'ils provoquent, le cas échéant. Les CIEP sont essentiellement financés sur des crédits de la mission interministérielle de lutte contre les drogues et la toxicomanie (MILDT) mais bénéficient également de financements complémentaires de l'AFSSAPS.
Une discussion assez vive a eu lieu à cette occasion et a permis d'aborder la question de la rationalisation des moyens de fonctionnement. Ainsi, le président de la Fédération française des industries de la santé a souhaité « une vraie gestion des subventions accordées par l'AFSSAPS ». En regard de la montée en puissance des subventions, il a suggéré qu'une étude annuelle soit effectuée par le conseil d'administration sur l'attribution des subventions accordées et leurs priorités : « une réelle gestion budgétaire de ce poste de dépenses lui semble nécessaire. Il fait part de l'intérêt qu'il y aurait à connaître la courbe de croissance des subventions depuis 1993 ».
Quant au contrôleur financier de l'Agence, il a relevé « un manque de lisibilité financière et budgétaire. Il suggère d'établir [...] un plan de contrôle financier et budgétaire sur la situation locale. Il est nécessaire d'avoir des tableaux de bord et de mettre en place un contrat d'objectifs et de moyens entre l'Agence et ces centres [les CIEP] ». Il a ajouté qu'il accorderait « son visa uniquement s'il obtient plus d'informations d'ordre budgétaire et financier ».
L'attribution de subventions à des associations était également inscrite à l'ordre du jour de la réunion du conseil d'administration du 30 mai 2002. Le procès-verbal de cette réunion indique que le contrôleur financier de l'établissement « ne comprend pas sur quels critères a été déterminé le montant des trois subventions » que le conseil d'administration examinait ce jour-là. Pour ce type de dossier, « un argumentaire doit être joint au projet de convention et au budget afin de mieux connaître la nature des missions ». Il a également rappelé qu' « une subvention, selon les règles budgétaires, ne doit pas servir à payer le personnel ».
Suite à ces interrogations, il avait été décidé la création d'une cellule chargée d'examiner les bilans financiers des opérations subventionnées et d'effectuer des contrôles ponctuels sur pièces et sur place. Ce projet n'a guère avancé, comme le prouve d'ailleurs la réponse particulièrement vague de l'AFSSAPS : « il existe à ce jour une procédure de suivi, de gestion et de contrôle des subventions. La direction de l'administration et des finances réfléchit actuellement à l'élaboration d'une nouvelle procédure qui permettrait un contrôle plus strict tant en amont qu'en aval de la procédure ».
4. Une trop grande priorité accordée aux missions traditionnelles de l'Agence
La Cour des comptes, au moment de son contrôle, c'est-à-dire entre la fin 2000 et le début de l'année 2001, avait jugé que l'AFSSAPS n'avait pas encore pris totalement le contrôle de son champ de compétences, ce qui avait notamment pour conséquence de handicaper la fixation des prix des médicaments par la commission de la transparence.
L'Agence avait surtout donné la priorité aux aspects qui engagent sa responsabilité , alors que, dans les autres domaines, les produits cosmétiques par exemple, les moyens mis en oeuvre l'avaient été moins rapidement. De même, l'évaluation des dispositifs médicaux n'était pas en place, alors que ce poste de dépenses a augmenté de 16 % en 2002.
Lors de son audition, le directeur général de la santé a fait le même constat. Il a en effet estimé que les moyens alloués par l'AFSSAPS aux autorisations de mise sur le marché sont beaucoup plus importants que ceux affectés à la commission de la transparence, alors que les AMM sont aujourd'hui très largement dictées par la réglementation communautaire et délivrées par l'Agence européenne du médicament.
L'AFSSAPS a précisé à votre rapporteur que les moyens du secrétariat de la commission de la transparence avaient été constamment augmentés au fil des ans, l'effectif étant passé de 14 personnes en 1997 à 22 personnes depuis 2002. Concernant les personnes directement en charge de l'évaluation des dossiers, le nombre d'évaluateurs internes a été porté de 7 personnes, toutes pharmaciens, à 11 personnes, dont 5 médecins, depuis 2002. L'encadrement, assuré auparavant par une seule personne, un pharmacien, est maintenant assuré par deux personnes à temps plein, toutes deux médecins.
Votre rapporteur tient cependant à rappeler que les moyens limités de la commission de la transparence sont, en partie, à l'origine du récent décret du Conseil d'Etat annulant un arrêté du 14 septembre 2001 qui avait diminué le taux de remboursement de certains médicaments. L'arrêté annulé avait fait passer les médicaments concernés, le Duxil et le Trivastal 23 ( * ) , du taux de remboursement de 65 % à 35 %, le taux de remboursement résultant de l'inscription des médicaments sur des listes, sur avis de la commission de la transparence. Or, dans son arrêt Société Servier Monde, du 20 juin 2003, le Conseil d'Etat a notamment mis en évidence l'insuffisante motivation des avis de la commission de la transparence, qui se bornent à affirmer, par exemple, qu'il existe des alternatives thérapeutiques sans indiquer lesquelles.
Cet arrêt a été rendu alors que d'autres recours de même nature sont en cours d'examen et que le gouvernement prépare de nouvelles mesures de déremboursement, indispensables compte tenu de l'insuffisance du service médical rendu (SMR) de certains médicaments mais aussi du coût qu'ils font néanmoins peser sur les dépenses d'assurance maladie.
Ainsi les moyens mal calibrés de la commission de la transparence ont-ils, en partie, des répercussions directes sur la politique de maîtrise des dépenses de santé.
D'une manière générale, les questions liées au remboursement des médicaments sont désormais essentielles. Pourtant, toujours selon le directeur général de la santé, l'observatoire national des prescriptions, placé auprès de l'AFSSAPS, ne fonctionne pas bien.
|
L'observatoire national des prescriptions Créé par arrêté du 19 septembre 1996, l'observatoire national des prescriptions et consommations des médicaments dans les secteurs ambulatoire et hospitalier est placé auprès du ministre chargé de la santé. Le comité d'orientation, qui comprend 20 membres, est nommé par le ministre et son secrétariat est assuré par la direction des études médico-économiques et de l'information scientifique de l'AFSSAPS. L'observatoire bénéficie ainsi du support technique de l'Agence : secrétariat, analyse épidémiologique, méthodologique, statistique, soutien au groupe d'experts... L'orientation des travaux et leur validation sont effectuées par le comité d'orientation et son président. L'actuel comité d'orientation a été nommé le 17 octobre 2000 et son président est le professeur Patrick Choutet. Sa lettre de mission a été signée par le ministre le 6 juin 2001. La mission de l'observatoire est de recueillir, analyser et diffuser sous les formes appropriées les informations relatives à la consommation et à la prescription des médicaments. L'objectif des travaux entrepris est de mesurer la consommation des médicaments ainsi que les déterminants de son évolution, de connaître les pratiques thérapeutiques, de vérifier l'adéquation entre prescription et consommation et d'identifier les écarts par rapport aux référentiels. Une comparaison avec les données internationales, notamment celles de l'Union européenne, est souhaitée. L'observatoire national a également pour mission de contribuer au développement des outils pérennes d'observation. Parmi les travaux de la lettre de mission de juin 2001, on peut citer : - des travaux sur des classes pharmaco-thérapeutiques ou des spécialités pharmaceutiques, en particulier le suivi de la chimiothérapie du cancer du sein et la classe des antiulcéreux ; - la création d'un répertoire des études et des sources d'information. Le projet d'un répertoire des études et des sources de données sur l'utilisation et la consommation des médicaments a débuté. Le recueil des données et des informations a débuté le 16 juin 2003 ; - la validation de la méthodologie des études observationnelles déposées par les industriels à la demande de la commission de la transparence et/ou du comité économique des produits de santé (CEPS). A ce jour, l'observatoire a reçu une vingtaine de saisines (spécialité, classe thérapeutique, indication thérapeutique), ce qui a donné lieu à une soixantaine de débats en comité d'orientation. |
L'AFSSAPS a, d'une certaine manière, reconnu que l'observatoire national des prescriptions ne fonctionnait pas bien puisque, sans vouloir se prononcer explicitement sur le jugement du directeur général de la santé, elle n'en a pas moins dressé la liste de aspects à réformer : « il convient de noter que les missions de l'observatoire seront revues à l'occasion de la réforme de la commission de la transparence. La mission d'évaluation méthodologique des études « en vie réelle », effectuées à la demande de la commission ou du CEPS, devrait être précisée et renforcée. La mission de réalisation d'études de suivi de prescription et de consommation sera probablement réévaluée ».
C. L'AUGMENTATION PARALLÈLE DES MOYENS DE LA DIRECTION GÉNÉRALE DE LA SANTÉ
1. Une augmentation parallèle des effectifs de la DGS et de l'AFSSAPS
La création de l'AFSSAPS s'est traduite, concrètement, par un transfert de certaines compétences de l'administration centrale , en l'occurrence la direction générale de la santé (DGS), vers une agence . La nature des missions de cette dernière s'en est trouvée modifiée, puisqu'elle a été déchargée de l'ensemble des tâches de gestion engendrées par la mise en oeuvre de la réglementation relative aux produits de santé, ainsi que de la responsabilité directe en matière de sécurité sanitaire . En contrepartie, elle a dû assumer la tutelle de l'AFSSAPS et définir la politique concernant les produits relevant désormais de la responsabilité de l'Agence.
Ainsi, alors que l'Agence du médicament d'abord, l'AFSSAPS ensuite, ont exercé des missions dévolues, à l'origine, au ministère de la santé, les moyens des services de ce dernier n'ont pas diminué. Les moyens de l'Agence et ceux de la DGS ont augmenté parallèlement, bien que la seconde ait abandonné un nombre croissant de ses missions au bénéfice de la première.
La direction générale de la santé a indiqué à votre rapporteur que « toute comparaison sur le moyen terme doit prendre en compte à la fois les modifications de périmètre des compétences de la DGS et l'évolution des sujets dont elle a la charge. Le champ de compétence de la DGS s'était stabilisé après 1994. En effet, en 1993, la création de l'Agence du médicament a conduit la DGS à intégrer dans son champ d'action les compétences restant à l'Etat en matière de médicament et d'officines (une quarantaine de personnes) puis, en 1994, la DGS a repris les fonctions et les personnels (une trentaine de personnes) de l'Agence française de lutte contre le SIDA (AFLS) dissoute par les pouvoirs publics. Il a, par contre, été profondément modifié en 2000, du fait de la réorganisation du pôle santé du ministère de l'emploi et de la solidarité. Cette réorganisation a abouti au transfert de la gestion des professions de santé mais l'a conduite à afficher une organisation destinée à prendre réellement en charge les missions de santé publique et de sécurité sanitaire qu'elle ne pouvait assumer, dans les faits, faute de moyens suffisants dans l'organisation antérieure ».
Votre rapporteur rappellera simplement que le thème de « l'insuffisance des moyens » de l'administration centrale des ministères sociaux est récurrent et qu'il doit parfois être nuancé 24 ( * ) . En revanche, il ne peut que constater que la DGS a vu ses effectifs nettement croître, à un moment où l'Etat renforçait ses moyens dans le domaine sanitaire en créant plusieurs agences.
Ainsi, les effectifs attribués de la DGS sont restés stables entre 1997 et 1999, soit environ 300 postes. Ils ont fortement augmenté en 2000, avec 41 postes supplémentaires par rapport aux effectifs 1999 selon le champ de compétences 2000. En effet, les effectifs attribués de 2000 ne peuvent être comparés aux effectifs attribués de l'année précédente, sans prendre en compte la modification intervenue, en 2000, dans les missions de la DGS qui a conduit au transfert de 17 postes :
|
Evolution des emplois de la DGS de 1997 à 2002 |
||||||||
|
1997 |
1998 |
1999 |
Transferts liés
|
1999 avec le
|
2000 |
2001 |
2002 |
|
|
Effectifs attribués |
303 |
297 |
296 |
-17 |
279 |
320 |
346 |
369 |
|
Dont catégorie A |
192 |
186 |
184 |
-7 |
177 |
220 |
246 |
264 |
|
Source : DAGPB et DGS |
||||||||
L'augmentation des effectifs de la DGS n'en est que plus flagrante : à champ de compétences équivalent, le nombre d'agents de cette direction est passé de 279 en 1999 à 369 en 2002. Sur quatre ans, les effectifs de la DGS ont ainsi progressé de 32,3 %.
Au sein de cette évolution globale, il convient de noter la progression des effectifs attribués à la sous-direction de la politique des produits de santé (SD3), qui est en charge du suivi de l'activité scientifique et technique, notamment de l'AFSSAPS : 35 en 2000, 39 en 2001 et 45 en 2002.
Néanmoins, ici également, les vacances de postes sont importantes, si bien que les effectifs réels sont moins élevés que les effectifs théoriques :
|
Effectifs réels de la DGS en 2000, 2001 et 2002 |
|||
|
Effectifs réels |
2000 |
2001 |
2002 |
|
DGS |
268 |
308 |
314 |
|
SD3 |
30 |
36 |
36 |
|
Source : DGS |
|||
2. L'évolution plus délicate à apprécier des moyens de fonctionnement de la DGS
Comme l'a indiqué la direction générale de la santé, « les opérations financées ou subventionnées par la DGS n'entrent plus dans le périmètre d'intervention de l'Agence », « excepté pour le projet France Coag [dispositif de suivi national des hémophiles] , dont les crédits et le traitement du dossier ont été transférés de l'AFSSAPS à la DGS en 2001, pour 533.000 euros ».
Les budgets de la DGS ont évolué de la manière suivante :

Certes, et la DGS a d'ailleurs attiré l'attention sur ce point, « ces deux budgets [celui de l'AFSSAPS et celui de la DGS] ne sont en rien comparables, l'un reflétant les moyens de fonctionnement de l'Agence, l'autre les moyens d'intervention du ministère de la santé dans des domaines totalement différents de ceux couverts par l'Agence ».
Il n'en demeure pas moins que le transfert d'une partie des compétences de l'administration centrale vers l'AFSSAPS aurait dû, logiquement, se traduire par une diminution des dotations budgétaires de la DGS.
Certes, depuis 2000, ces dotations ont bien diminué, de 22,3 %, passant de 402,86 millions d'euros en 2000 à 312,92 millions d'euros en 2003, soit environ 90 millions d'euros de moins. Toutefois, cette évolution est indépendante des transferts de compétences susmentionnés, qui ont eu lieu en 1999 . Les années de comparaison pertinentes sont 1999 et 2000, puisqu'elles permettent d'apprécier les conséquences budgétaires de ces transferts de compétences. Malheureusement, et en dépit de la demande formulée par votre rapporteur auprès de la DGS, les informations antérieures à 2000 ne lui avaient pas été communiquées à la date de publication du présent rapport d'information.
D. UNE AGENCE HANDICAPÉE PAR LES CARENCES DES SERVICES DE L'ÉTAT
1. Le retard des textes d'application des dispositions législatives
De nombreuses dispositions législatives et réglementaires relatives aux domaines de compétences de l'AFSSAPS souffrent d'un important retard de publication de leurs textes d'application.
Cette situation constitue un handicap à l'exercice par l'AFSSAPS de ses missions, notamment dans le périmètre de ses compétences nouvelles.
Elle est en effet potentiellement préjudiciable aux missions de sécurité sanitaire de l'Agence :
1) évaluation des produits de santé : l'absence de textes dans ce domaine pose un réel problème pour l'évaluation et le contrôle, notamment des produits thérapeutiques annexes, c'est-à-dire la culture des cellules, des préparations hospitalières et des procédés et produits de cession de tissus et cellules ;
2) qualité des vigilances sur les produits : les décrets d'application sont également quasiment inexistants en matière de biovigilance (organes, tissus et cellules), réactovigilance (réactifs de laboratoires) et cosmétovigilance ;
3) contrôle des laboratoires et inspection des établissements : dans ces domaines, sont prévus des régimes déclaratifs ; or, l'Agence ne connaît pas le nombre d'établissements qui doivent être contrôlés ; de même, les référentiels d'inspection ne peuvent être appliqués.
Ces retards importants dans la publication des décrets d'application tiennent en partie à la complexité et à la longueur de la procédure d'élaboration des textes, qui font l'objet de nombreux « allers-retours » entre la DGS et l'Agence, sans compter les détours par le niveau communautaire 25 ( * ) .
La direction générale de l'Agence a communiqué à votre rapporteur, à sa demande, un tableau de bord des textes en cours d'élaboration.
Au 12 février 2003, 50 textes étaient encore en attente de publication , dont 16 décrets en Conseil d'Etat, 7 décrets simples, 14 arrêtés et 13 arrêtés sur proposition du directeur général de l'AFSSAPS.
|
50 textes d'application attendus au 12 février 2003 Au 12 février 2003, les textes d'application dont la publication était attendue concernaient les domaines suivants : - aliments diététiques destinés à des fins médicales spéciales : 3 décrets en Conseil d'Etat ; - produits cosmétiques : 1 décret en Conseil d'Etat, 1 arrêté et 2 arrêtés pris sur proposition du directeur général de l'AFSSAPS ; - produits thérapeutiques annexes : 2 décrets en Conseil d'Etat et 1 arrêté sur proposition de l'Agence ; - produits de thérapies génique et cellulaire : 1 arrêté interministériel pris sur proposition de l'AFSSAPS ; - tissus, cellules et produits issus du corps humain : 1 décret en Conseil d'Etat, 1 arrêté et 3 arrêtés sur proposition de l'AFSSAPS, dont l'un nécessite l'avis de l'Etablissement français des greffes (EFG) et de l'AFSSA ; - préparations hospitalières : 2 arrêtés et 1 arrêté sur proposition de l'Agence ; - médicaments : 3 décrets en Conseil d'Etat et 2 arrêtés ; - dispositifs médicaux : 2 décrets en Conseil d'Etat, 1 décret simple et 3 arrêtés ; - dispositifs médicaux de diagnostic in vitro : 1 décret en Conseil d'Etat, 2 décrets simples et 2 arrêtés sur proposition de l'AFSSAPS ; - analyses de biologie médicale : 2 arrêtés sur proposition de l'Agence ; - matières premières à usage pharmaceutique : 1 décret en Conseil d'Etat, 1 décret simple, 1 arrêté et 2 arrêtés sur proposition de l'Agence ; - APSI : 1 décret en Conseil d'Etat ; - produits sanguins : 1 décret simple et 2 arrêtés, dont l'un sur proposition de l'AFSSAPS et après avis de l'Etablissement français du sang ; - biocides : 1 décret en Conseil d'Etat et 1 arrêté ; - essais cliniques : 2 décrets simples. |
2. Des recoupements de compétences avec d'autres agences de sécurité sanitaire
La loi du 1 er juillet 1998 précitée a également institué, dans son article 1 er , devenu l'article L. 1413-1 du code de la santé publique, un comité national de la sécurité sanitaire.
Celui-ci doit, notamment, s'assurer de la coordination de la politique scientifique de l'InVS, de l'AFSSAPS, de l'AFSSA et de l'Agence française de sécurité sanitaire environnementale (AFSSE). Présidé par le ministre de la santé, il réunit les directeurs généraux de l'InVS et des trois agences de sécurité sanitaire, ainsi que les présidents de leur conseil scientifique, une fois par trimestre, à la demande de l'un d'entre eux ou immédiatement en cas de déclenchement d'une crise sanitaire.
Le législateur avait décidé de créer cette instance de coordination car il avait bien conscience d'éventuels recoupements de compétences entre les différentes agences de sécurité sanitaire.
Le comité national de la sécurité sanitaire
Le comité national de la sécurité sanitaire (CNSS) a été créé par la loi du 1 er juillet 1998 précitée. Sa composition et ses missions ont été modifiées par la loi du 9 mai 2001 créant l'Agence française de sécurité sanitaire environnementale (AFSSE).
Le CNSS est chargé :
- d'analyser les événements susceptibles d'affecter la santé de la population ;
- de confronter les informations disponibles ;
- de s'assurer de la coordination des interventions des services de l'Etat et des établissements publics placés sous sa tutelle, notamment pour la gestion, le suivi et la communication des crises sanitaires.
Ce comité s'assure également de la coordination de la politique scientifique de l'InVS, de l'AFSSAPS, de l'AFSSA et de l'AFSSE.
Le rôle de coordination du CNSS résulte, en premier lieu, de sa composition. En effet, il fonctionne comme une instance interministérielle d'échanges, d'analyse et de concertation en associant, en tant que de besoin, les principales directions des ministères concernés (la direction des relations du travail, la direction générale de la concurrence, de la consommation et de la répression des fraudes, la direction générale de l'alimentation, la direction de l'eau, la direction des pollutions et de la prévention des risques, la direction générale de la santé et la direction de l'hospitalisation et de l'organisation des soins) et l'ensemble des établissements publics nationaux intervenant dans le champ de la sécurité sanitaire et de la santé publique.
Par ailleurs, la démarche de coordination du CNSS, au travers de son activité, est de constituer un fonds méthodologique commun aux différentes parties sur l'analyse et la gestion des risques sanitaires.
Lors de ces séances, le comité tire les conséquences des crises, évalue les risques émergents et tente d'élaborer une démarche innovante en matière d'analyse prospective.
Plus qu'une analyse à chaud des questions d'actualité, le CNSS privilégie le retour d'expérience.
Au cours des différents CNSS, les sujets suivants ont été mis à l'ordre du jour, et certains ont fait l'objet d'un communiqué de presse : politique de lutte contre l'ESB 26 ( * ) , listériose, transfusion sanguine, conséquences de la marée noire de l'Erika, aluminium et maladie d'Alzheimer, problèmes liés au piercing, éthers de glycol, dioxines, légionellose, pesticides, allergies alimentaires, plan Biotox, vaccination contre les méningites dans le Puy-de-Dôme, Métaleurop...
Dans le même temps, des groupes de travail ont été constitués au sein du CNSS pour faire avancer la réflexion sur les sujets suivants :
- critères, méthodes et procédures des processus de décision ;
- estimation quantitative du risque en situation d'incertitude ;
- analyse prospective des alertes.
|
Toutes ces réunions ont pour but d'assurer la coordination interministérielle de la politique scientifique et technique des agences, dans le domaine de la sécurité sanitaire ; mais cette forme de coordination ne s'apparente pas à une fonction de tutelle. En marge du CNSS proprement-dit, le directeur général de la santé réunit tous les 15 jours les directeurs des agences de sécurité sanitaire pour examiner les alertes et assurer une articulation des agences, entre elles et avec la DGS, pour une réponse la plus pertinente possible aux situations d'alerte et de crise potentielle. Ces réunions permettent d'ailleurs de faire des propositions de sujets à mettre à l'ordre du jour des réunions du CNSS. Source : direction générale de la santé |
Il existe indéniablement des domaines d'intérêt commun entre les agences de sécurité sanitaire. Sur le plan administratif, le statut des personnels contractuels est un problème à peu près réglé aujourd'hui 27 ( * ) , mais une réflexion approfondie devrait être engagée, notamment avec l'AFSSA, sur la politique d'achats publics ou sur l'appréhension des dispositifs du nouveau code des marchés publics. Sur le plan scientifique, l'Agence pourrait davantage se concerter avec l'AFSSA ou avec l'InVS, notamment pour traiter de sujets intervenant en aval de la mise sur le marché des médicaments, peu d'études de cohortes sur les effets des médicaments ou sur les interactions entre médicaments étant réalisées.
Dans leurs activités de gestion quotidienne, les agences ont dû mettre en place des procédures de coordination, dont l'ensemble paraît indéniablement complexe .
Il convient d'abord d'insister sur le fait que l'AFSSAPS a dû mettre en place, en son sein, un comité de coordination des vigilances , « afin d'améliorer la cohérence des différents systèmes et d'obtenir une vision globale des vigilances des produits de santé ». L'Agence a également indiqué à votre rapporteur qu' « une réflexion sur la coordination locale et régionale des vigilances est actuellement menée avec la DHOS et la DGS, en articulation avec les démarches et études en cours sur la gestion des risques ».
En outre, dans le cadre de ce comité de coordination des vigilances, plusieurs réunions ont été organisées à l'initiative de l'AFSSAPS avec la participation de l'AFSSA, l'InVS et des représentants de différents ministères pour la conduite de dossiers communs sur les aspects de toxicité de différents produits : éthers de glycol, aluminium, fluor, stupéfiants et psychotropes.
Par ailleurs, l'Agence a mis en place des mécanismes de coordination plus ou moins institutionnalisés avec d'autres agences de sécurité sanitaire.
Avec l'AFSSA, en raison de l'existence de pôles d'intérêt communs (réglementation, produits, procédures), ce qui n'était alors que l'Agence du médicament a développé, depuis octobre 1994, des relations avec l'agence nationale des médicaments vétérinaires (ANMV), qui a été intégrée au sein de l'AFSSA en 1999, en vue d'échanges réguliers d'informations. Ainsi, un représentant de l'AFSSAPS participe depuis lors régulièrement à la commission d'autorisation de mise sur le marché des médicaments vétérinaires, tandis que le président de la commission de pharmacovigilance des médicaments à usage humain est membre de droit de la commission de pharmacovigilance des médicaments à usage vétérinaire. En outre, des représentants de l'ANMV participent aux réunions de certains groupes de travail de la pharmacopée, dont le secrétariat est assuré par l'AFSSAPS.
Afin d'accentuer les échanges en matière d'inspection, un projet de convention permettant la formation d'inspecteurs de l'ANMV par le biais du plan de formation est en cours de finalisation.
En outre, les services d'inspection des médicaments de l'AFSSAPS et de l'AFSSA sont convenus que les établissements pharmaceutiques fabriquant simultanément des médicaments à usage humain et à usage vétérinaire seraient, pour l'essentiel, inspectés par l'AFSSAPS, celle-ci informant l'AFSSA de toute mesure administrative, ordinale ou pénale prise à l'encontre de l'un de ces établissements. En cas de nécessité, des inspections conjointes sont envisagées. Enfin, un échange d'information est prévu entre les agences lors de toute demande d'ouverture visant à une activité mixte de médicaments humains et vétérinaires.
Si la direction générale de l'AFSSAPS a estimé que « ces modalités permettent une optimisation des ressources d'inspection de l'AFSSA, mais aussi de garantir l'homogénéité de traitement entre les établissements », il n'en reste pas moins vrai que cette optimisation résulte d'usages et non de la réglementation, qui pourrait donc être simplifiée . Ainsi, elle prévoit que l'AFSSAPS est compétente en matière de substances vénéneuses mais l'avis du directeur général de l'AFSSA est requis dans plusieurs cas. De surcroît, les échanges d'informations nécessitent des moyens et engendrent des procédures administratives supplémentaires.
Plusieurs actions de coordination dans le domaine du médicament ont été mises en oeuvre : information en matière d'antibiorésistance, synthèse sur les médicaments en réserve hospitalière pour lesquels des vétérinaires souhaitent une mise à disposition, échanges d'informations diverses sur les médicaments dans le cadre de la commission d'autorisation de mise sur le marché vétérinaire...
Enfin, en matière de transposition des textes communautaires, une coordination avec l'ANMV est assurée a minima sur tous les projets d'intérêt commun : médicaments, organismes génétiquement modifiés, biocides.
S'agissant des recommandations de bonnes pratiques , l'AFSSAPS se coordonne avec les agences de veille, de sécurité et de vigilance sanitaire, notamment avec l'AFSSA (pour le fluor ou le détournement des produits à usage vétérinaire), l'InVS (pour l'hépatite C) et l'Agence nationale d'accréditation et d'évaluation en santé (ANAES), pour la dyslipidémie ou la contraception...
L'AFSSAPS est également amenée à collaborer avec d'autres départements ministériels que celui de la santé.
Un protocole a ainsi été élaboré avec la direction générale de la concurrence, de la consommation et de la répression des fraudes (DGCCRF), dans les domaines de l'inspection et du contrôle des produits. Ce protocole vise l'échange d'informations ainsi que la coordination des programmes d'inspection et de contrôle des deux organismes, y compris la réalisation d'inspections conjointes.
L'AFSSAPS s'est rapprochée de la direction générale de la sûreté nucléaire et de la radioprotection (DGSNR) dans le cadre de la mise en oeuvre du décret du 4 avril 2002 relatif à la protection générale des personnes contre les dangers des rayonnements ionisants. Ce décret définit en effet les conditions dans lesquelles certains établissements fabriquant des médicaments radiopharmaceutiques ou des dispositifs médicaux contenant des radionucléides sont autorisés par le directeur général de l'AFSSAPS. D'autre part, l'Agence exerce la responsabilité du contrôle de l'utilisation des dispositifs contenant des radionucléides. La collaboration entre les deux établissements dans ces différents domaines se traduit par l'élaboration conjointe de textes d'application du décret, de procédures d'instruction et d'organisation des inspections.
Votre rapporteur considère que la simplification de l'organisation d'ensemble des agences sanitaires est certes nécessaire mais qu'il convient avant tout - et c'est l'objectif du ministère - de réformer en interne l'AFSSAPS.
Les enjeux de la réorganisation de l'Agence sont en effet considérables, ne serait-ce que sur le plan législatif et réglementaire : s'il demeure légitime de vouloir rapprocher l'AFSSAPS, l'Etablissement français des greffes (EFG) et la nouvelle agence de biomédecine, créée par le projet de loi sur la bioéthique en cours de discussion au Parlement, ce rapprochement nécessiterait de modifier, selon le ministère, pas moins de 120 textes !
De surcroît, l'AFSSAPS doit compter avec les institutions communautaires. L'Agence européenne du médicament est de création relativement récente. Ses travaux sont réalisés, pour l'essentiel, par des experts nationaux. Il convient de s'interroger sur la coexistence, dans ce domaine, de 15 agences nationales et d'une agence européenne. La création des agences nationales, quasi concomitante à l'apparition d'un marché devenant international, montre l'absence de réflexion préalable sur ce sujet. Il serait ainsi concevable de développer le niveau européen, et de redéployer les moyens en interne pour effectuer des études sur les conditions et les conséquences des autorisations de mise sur le marché.
III. POURSUIVRE LES MUTATIONS ENTREPRISES
A. L'ENGAGEMENT DE VÉRITABLES EFFORTS
1. En matière de préparation du contrat d'objectifs et de moyens et de mise en place d'indicateurs
La Cour des comptes, dans son rapport de septembre 2000 sur la sécurité sociale, avait souligné l'insuffisance de vision stratégique de l'AFSSAPS, que traduisent le moindre recours aux lettres de mission et la lenteur du rythme d'élaboration des contrats d'objectifs et de moyens.
La direction générale de la santé a indiqué que, « concernant le premier point de [cette] remarque, sa pertinence tend à s'estomper », donnant plusieurs exemples d'envoi de lettres de mission, qui ne concernent toutefois pas l'AFSSAPS mais d'autres établissements intervenant dans le domaine sanitaire. « En ce qui concerne la lenteur du rythme d'élaboration des contrats d'objectifs et de moyens, il faut souligner que ces derniers ont tous été initialisés au plus tard en 2002, soit dans les délais compatibles avec la demande faite en 2000 par le Premier ministre ».
Il n'en reste pas moins vrai que, comme l'a d'ailleurs admis la direction générale de l'Agence, la procédure initialement prévue pour élaborer et conclure le contrat d'objectifs et de moyens a pris du retard.
Néanmoins, cette procédure semble avoir aujourd'hui véritablement avancé, et l'AFSSAPS a indiqué à votre rapporteur que « la première proposition d'indicateurs (sur les missions de l'Agence) est actuellement en discussion et sera transmise dans les prochains jours à la DGS. Ces indicateurs seront renseignés à titre expérimental à partir de septembre 2003. La discussion sur le projet de contrat d'objectifs et de moyens devrait se faire à l'automne 2003 pour une signature au cours du premier trimestre 2004 entre l'Agence, la DGS, la DAGPB et le ministère du budget ».
Un auditeur de gestion avait d'ailleurs été recruté en janvier 2003, à cette fin. Il est placé sous la responsabilité du secrétaire général. Sa première tâche consiste à établir un premier référentiel d'indicateurs qui vont porter in fine sur l'activité spécifique de l'Agence, mais également s'appuyer sur le travail conduit en 2001 et 2002 par les tutelles et les agences de sécurité sanitaire.
L'objectif reste donc de déterminer des indicateurs opérationnels discutés avec la tutelle à l'automne 2003.
2. En matière de gestion des ressources humaines
Le Laboratoire national de la santé (LNS), administration centrale de l'Etat créée en 1950, avait été doté de statuts particuliers pour ces personnels scientifiques 28 ( * ) et techniques. Le décret n° 93-697 du 25 mars 1993 disposait que le LNS était supprimé et que ses personnels étaient affectés à l'Agence du médicament qui venait d'être créée par la loi n° 93-5 du 5 janvier 1993 relative à la sécurité en matière de transfusion sanguine et de médicament et par le décret n° 93-295 du 8 mars 1993.
Le décret de 1985, qui définissait les dispositions statutaires applicables aux personnels scientifiques du LNS, a été abrogé en 1998 afin d'élaborer, en le modernisant et en l'adaptant aux enjeux de l'Europe du médicament, le nouveau statut des personnels concernés. Cette réforme devait doter l'établissement de personnels disposant des compétences médicales, pharmaceutiques, scientifiques et techniques nécessaires à l'accomplissement de ses missions de contrôle et de recherche telles que définies à l'article L. 567-2 du code de la santé publique. Tel était l'objet du décret n° 98-385 du 18 mai 1998 portant statut particulier des personnels scientifiques de l'Agence du médicament. Ce texte permettait, outre la revalorisation des carrières des différents grades du corps, la fusion des deux premiers grades du corps, les assistants de laboratoire étant intégrés dans le grade supérieur de chef de projet à la date de publication du décret. Enfin, le texte permettait une délégation de pouvoirs du ministre chargé de la santé au directeur général de l'établissement public en matière de recrutement, de nomination et de gestion des personnels .
Parallèlement à cette réforme, l'Agence du médicament se dotait d'un quasi-statut 29 ( * ) pour ses personnels contractuels de droit public lui permettant d'offrir un contrat à durée indéterminée à ses agents et de leur garantir un déroulement de carrière, faisant ainsi aboutir la principale revendication des représentants du personnel.
La loi du 1 er juillet 1998 précitée et le décret n° 99-142 du 4 mars 1999 ont créé l'AFSSAPS et transféré juridiquement les personnels de l'Agence du médicament à celle-ci.
L'AFSSAPS s'est ainsi engagée, dès l'été 2000, dans une réflexion globale sur la réforme de l'ensemble de ses statuts afin de garantir une véritable égalité de traitement entre ses différentes catégories de personnel. Aussi, dans le souci d'uniformiser les rémunérations et les déroulements de carrière au sein des différentes directions de l'établissement et de réduire les disparités liées à l'histoire, une révision des dispositions statutaires des personnels de laboratoire était nécessaire parallèlement à celle qui a été entreprise pour les personnels contractuels.
La modification du texte statutaire des personnels scientifiques de l'AFSSAPS est le dernier volet de la réforme complète des référentiels des ressources humaines entreprise depuis 2000. Les modifications réglementaires modestes, les simplifications qu'elle comporte et son incidence financière modérée ne lui retirent pas le caractère de dernière étape de la partie juridique de la réforme. La nécessité de grilles de rémunérations adaptées et prenant en compte les nouveaux métiers de l'Agence ont conduit à une réforme des quasi-statuts des personnels contractuels, qui repose sur trois axes :
- modernisation et mise en adéquation des grilles et des rémunérations accessoires avec celles existant dans des emplois similaires de la fonction publique et de la fonction publique hospitalière ;
- reclassement supprimant les dispositions liées à la date de recrutement et permettant une saine gestion des ressources humaines ;
- mobilité entre les agences du domaine de la santé assumant la cohérence de la politique de ressources humaines.
Ce projet a été mené en interne au sein du même groupe de travail que la réforme des personnels contractuels, en concertation avec les cinq organisations syndicales de l'établissement. Des réunions de travail ont parallèlement été organisées avec la direction du budget et la direction générale de l'administration et de la fonction publique.
La réforme s'articule autour de trois axes majeurs qui sont la révision des grilles des quatre grades du corps, la redéfinition des modalités d'accès aux grades de chefs de laboratoire et directeurs de laboratoire et, enfin, la définition de nouvelles modalités de reclassement.
a) La publication d'un nouveau décret statutaire
• Révision des déroulements de carrière et des grilles de rémunération
Dès juillet 2000, les principes généraux de la réforme statutaire engagée par l'AFSSAPS étaient définis avec pour objectif d'uniformiser les règles de gestion des différents types de personnels de l'établissement. Aussi dans le souci d'avoir des déroulements de carrière et des niveaux de rémunération équivalents pour les personnels titulaires et contractuels, ont été revus :
- le déroulement indiciaire des assistants de laboratoire avec l'adjonction de deux échelons, dont deux exceptionnels, et l'allongement de la durée de la carrière. Ce grade offre ainsi un déroulement de carrière comparable à celui des personnels contractuels de seconde catégorie recrutés par l'AFSSAPS ou encore à celui des attachés d'administration centrale du ministère de la santé (grade de base) ;
- le déroulement indiciaire des chefs de projet (futurs chefs de laboratoire de 2 ème classe) avec la terminaison du grade à l'indice brut 1015 ;
- le déroulement indiciaire des chefs de laboratoire (futurs chefs de laboratoire de 1 ère classe) avec la terminaison du grade en hors échelle B ;
- la révision des premiers échelons du grade de directeurs de laboratoire afin d'offrir un déroulement de carrière cohérent avec celui des chefs de laboratoire de 1 ère classe qui y sont promus.
• Redéfinition des modalités d'accès aux grades de chefs de laboratoire et directeurs de laboratoire
Le projet de statut des personnels scientifiques devait répondre à un souci de simplification des procédures de gestion et permettre une meilleure identification des compétences. Pour cela, la transformation des grades de chef de projet et chef de laboratoire en deux grades de chef de laboratoire de 2 ème et 1 ère classe était proposée.
En effet, les mêmes conditions de diplômes sont aujourd'hui exigées pour ces deux grades, accessibles tous deux par concours sur titres et travaux ouverts aux candidats internes et externes. L'organisation récente de concours dans les deux grades actuels prouve que les mêmes candidats postulent indifféremment à l'un et l'autre. Enfin, la frontière entre les fonctions exercées par les agents de ces deux corps reste floue, certains chefs de projet encadrant des chefs de laboratoire.
C'est pourquoi il a été proposé de regrouper les deux grades en n'ouvrant l'accès à la 1 ère classe qu'à la promotion par tableau d'avancement. De la même manière, les modalités d'accès au grade de directeur de laboratoire sont revues, le grade n'étant plus accessible qu'à la promotion interne par la voie de l'examen professionnel. Précédemment ouvert aux praticiens hospitaliers, aux professeurs d'université et aux chefs de laboratoire de l'AFSSAPS, l'ouverture de concours n'a permis que la promotion de personnels de l'établissement, les praticiens hospitaliers et professeurs d'université (PHPU) n'étant pas intéressés par le statut proposé par l'Agence. Ceux-ci pourront néanmoins toujours intégrer le grade par détachement.
Cette modification des conditions d'accès et de progression rend ce corps cohérent avec les principes généraux de la fonction publique.
• Révision des modalités de reclassement du décret du 18 mai 1998
Enfin, la superposition dans le temps de grilles et de modalités de reprise d'ancienneté différentes avait engendré de véritables inégalités de traitement entre agents de même niveau exerçant le même type de responsabilités.
L'évolution des modalités de valorisation des expériences professionnelles a entraîné de véritables disparités entre les personnels recrutés avant et après la publication des nouvelles dispositions statutaires de 1998. Ces dernières permettent en effet une reprise d'ancienneté dans la limite de huit années, alors que le décret n° 85-89 du 21 janvier 1985 portant statut particulier des personnels scientifiques du LNS ne le prévoyait pas. Or les derniers concours organisés en 1997 avaient abouti à la titularisation de neuf agents dans le corps des personnels scientifiques dans les semaines qui avaient précédé la publication du nouveau décret. Ils n'ont par conséquent pas bénéficié de ces conditions de reclassement plus avantageuses, contrairement aux personnels qui ont été depuis intégrés par concours interne et externe et qu'ils encadrent bien souvent. Ces dispositions entraînent des disparités injustifiées entre agents du même corps, voire de même grade.
C'est la raison pour laquelle la révision des mesures de reclassement s'imposait afin d'être en adéquation avec les dispositions de reclassement prévues pour les personnels contractuels des établissements et atténuer les disparités entre les agents du corps et les futurs recrutés. Cette modalité de reclassement est un des piliers de la réforme. Elle devrait permettre à terme la mise en oeuvre d'une politique de ressources humaines cohérente et durable sur l'établissement et s'inspire par ailleurs des modalités de classement définies par les corps de pharmaciens et médecins inspecteurs de santé publique.
En dernier lieu, les modalités de reprise d'ancienneté lors de l'intégration dans le grade de chefs de laboratoire de 2 ème classe ont été révisées par l'adoption des dispositions en vigueur pour les pharmaciens et médecins inspecteurs de santé publique (reprise de l'expérience professionnelle à hauteur de 15 ans et non plus de 8 ans comme précédemment).
Ces différentes mesures ont été mises en oeuvre par le décret n° 2003-224 du 7 mars 2003 fixant les règles applicables aux personnels contractuels de droit public recrutés par certains établissements publics intervenant dans le domaine de la santé publique ou de la sécurité sanitaire.
Le décret précité n° 2003-224 traduit l'aboutissement de la réforme statutaire engagée par l'établissement depuis maintenant bientôt trois ans . Par rapport au texte de 1998, le décret permet une approche par métiers et compétences et met à la disposition des agences de véritables outils de gestion des ressources humaines (organisation d'une mobilité entre établissements, ventilation des rémunérations, valorisation des parcours individuels...).
Dans ce contexte, l'étude par métiers, amorcée en 2001, a été complétée par l'élaboration d'une classification des emplois de l'AFSSAPS, nécessaire au reclassement des agents en place et aux recrutements futurs. Un travail de coordination a parallèlement été mené avec les autres agences concernées par la réforme statutaire.
Ce préalable marque l' amorce de la réflexion sur une gestion prévisionnelle des emplois et des compétences à l'Agence . Dans cette optique, l'offre de formation continue a été complètement revue et adaptée aux évolutions des métiers et procédures de l'établissement (développement des stages dont le cahier des charges est écrit en collaboration avec les directions et qui sont co-animés en interne et en externe). De la même manière, la procédure d'élaboration du plan de formation 2003 permettant le regroupement d'un recensement individuel des besoins et des demandes prospectives des directeurs a permis la mise en place de plans individuels de formation .
L'approche par compétences est donc aujourd'hui privilégiée. Elle sera complétée par une réflexion sur l'articulation entre l'expertise interne et l'expertise externe. L'Agence rappelle toutefois l'intérêt de la réforme statutaire sans laquelle, cette réflexion pouvait difficilement être engagée. La publication du statut de mars 2003, et l'adoption prochaine de la délibération du conseil d'administration qui le complète, constituent la première étape de ces actions qui devrait être poursuivie sur plusieurs années.
b) Le redimensionnement de certaines équipes
La Cour des comptes avait par ailleurs noté un surdimensionnement des équipes travaillant sur le sujet de la thérapie génique, eu égard à la réalité actuelle de ce marché.
L'AFSSAPS a pris conscience de ce dysfonctionnement et y a apporté remède.
|
Le réajustement des équipes de thérapie génique Les projets concernant la thérapie génique ont été déjà réajustés compte tenu du développement de cette thérapeutique. Plutôt que de construire un grand laboratoire de thérapie génique avec une équipe entièrement dédiée, l'Agence a fait le choix de créer une unité de biologie cellulaire et moléculaire (BCM) et de réaménager des zones de laboratoire à partir de locaux existant peu utilisés. Le choix du directeur général s'est appuyé sur les réflexions d'un groupe de travail spécifique qui a été créé à sa demande et dont les conclusions ont été présentées au conseil scientifique. Ce travail de fond a permis de redimensionner le projet de façon plus adapté aux enjeux dans le domaine de la thérapie génique. Cette unité de BCM ne se consacre pas exclusivement aux produits de thérapie génique mais prend en charge des thématiques nécessitant une expertise de base commune. Elle est ainsi également impliquée dans le développement et la mise au point de méthodes alternatives à l'animal, dans les contrôles de tolérance et toxicité des produits cosmétiques, dans les contrôles de biocompatibilité des dispositifs médicaux. Les activités de l'unité BCM comportent une dimension recherche importante sur des thématiques de long terme. Les investissements actuels resteront justifiés, même si l'activité de thérapie génique ne devait pas se développer comme prévu initialement à la fin des années 1990. De toute façon, pour développer une activité de thérapie génique, il faut aménager les locaux pour les rendre aptes à recevoir un agrément. [...] La mesure de l'activité en thérapie génique sera faite dans le cadre du développement des indicateurs d'activité. Des indicateurs spécifiques à la mesure d'une activité de recherche et développement seront mis en place car cette activité n'est pas comparable à une activité de surveillance du marché ou de libération de lots ; elle comporte une dimension documentaire beaucoup plus importante et la notion de temps passé n'est pas le même lorsqu'il s'agit de mettre en place des techniques nouvelles que lorsqu'il s'agit de pratiquer des contrôles de routine sur la base de référentiels bien établis. À ce jour, à l'Agence, cinq emplois équivalent temps plein sont mobilisés sur la thérapie génique (3 ETP dans les laboratoires de contrôle et 2 en évaluation des essais cliniques). Il s'agit du minimum de personnel nécessaire à maintenir pour disposer à l'Agence de compétence dans ce domaine. Source : réponse de l'AFSSAPS à une question de votre rapporteur |
3. En matière d'expertise externe
Sur la base des travaux déjà engagés par l'Agence, en particulier par la cellule de veille déontologique, différentes actions sont en cours et devraient permettre, dès cette année, d'améliorer la prévention et la gestion des conflits d'intérêts et la rémunération des experts.
En premier lieu, une révision des listes des experts membres des groupes de travail ou des experts rapporteurs dans les commissions a été réalisée par les directions opérationnelles . Ces listes ont été publiées.
Parallèlement, un travail de vérification de la complétude de la base FIDES a été engagée et a été achevé à la fin du mois de juin 2003. Ce travail a été grandement facilité par la mise en service de la consultation de la base FIDES via Intranet par les secrétariats des commissions (projet FIDWEB, qui a reçu un avis favorable de la CNIL fin mai 2003). Cette consultation par les secrétariats devrait faciliter au quotidien la gestion des conflits éventuels lors des réunions des commissions et des groupes de travail. Par ailleurs, il est prévu de rappeler les règles déontologiques en vigueur lors du renouvellement des commissions. Ces règles sont d'ailleurs précisées dans les appels à candidature diffusés par le site Internet de l'Agence (matériovigilance, publicité, cosmétovigilance). Cette procédure devrait être progressivement généralisée dans l'année, notamment pour recruter de nouveaux experts rapporteurs.
Le transfert de la gestion des experts externes de la cellule de veille déontologique au département des ressources humaines a été décidé par le directeur général. Il devrait être effectif à l'automne 2003. Ce transfert vise à assurer une meilleure gestion des experts externes sur la base d'un guichet unique, à l'interface entre la base FIDES et l'application de gestion des ressources humaines CIRIL, avec pour objectif une amélioration des délais d'indemnisation des experts externes.
Il est à noter par ailleurs que le dispositif de rémunération des experts va être actualisé et permettra d'indemniser l'ensemble des commissions de l'AFSSAPS. Un accord a été notifié à l'Agence par les tutelles. Le décret serait en cours de signature.
|
Le nouveau dispositif de rémunération des experts externes de l'AFSSAPS Un nouveau dispositif de rémunération des experts externes est actuellement en cours de validation par les ministères de tutelle de l'Agence. Le précédent système de rémunération des experts scientifiques externes prévoyait que seuls les experts et les rapporteurs des commissions d'autorisation de mise sur le marché (AMM), de la transparence, du contrôle de la publicité, de pharmacovigilance, étaient rémunérés pour les rapports réalisés pour le compte de ces instances. Le taux des indemnités allouées aux experts et rapporteurs concernés était égal à environ 15,24 euros par vacation, cette indemnité ne pouvant excéder 100 vacations par an, soit un montant plafonné de 1524 euros. Le nouveau dispositif fixe les modalités de rémunération des membres des conseils, commissions et groupes d'experts, des experts et rapporteurs extérieurs qui concourent aux travaux de l'Agence, mais aussi des présidents de commissions et du conseil scientifique. Ainsi, en contrepartie de leur activité au bénéfice de l'Agence, les présidents de commission et le président du conseil scientifique perçoivent une rémunération forfaitaire allant de 4 à 12 vacations mensuelles. Le nombre de vacations allouées aux présidents est attribué selon l'importance du temps de présence à l'Agence et la complexité des dossiers examinés. Le taux de la vacation est fixé à 67 euros. Les experts et rapporteurs extérieurs et les membres du conseil scientifique, de commissions, de groupes d'experts ou de groupes de travail, exerçant une activité libérale à titre exclusif ou à titre mixte, perçoivent une indemnisation en contrepartie de leur participation aux réunions des instances scientifiques consultatives. Cette indemnisation est versée sous forme de vacations (le maximum annuel est de 22 vacations par personne). Le taux de la vacation est fixé à 15 fois la valeur de la lettre conventionnelle C (20 euros au 1 er juillet 2002) par demi-journée de présence. Le dispositif fixe également les principes de versement des rémunérations des experts, rapporteurs extérieurs et membres du conseil scientifique ou des commissions et groupes d'experts placés auprès de l'AFSSAPS, ou dont l'Agence assure le secrétariat, pour les rapports, les travaux et les études qu'ils réalisent pour le compte de ces instances. Un système transitoire de rémunération des experts externes a été fixé par le conseil d'administration de l'AFSSAPS par la délibération du 12 octobre 2001 et modifiée par la délibération du 11 décembre 2002. C'est ce système qui est en vigueur dans l'attente de la publication d'un décret interministériel prévoyant les principes de versement de vacations aux experts externes et de l'arrêté interministériel fixant les différents taux et les plafonds des vacations alloués à ces experts. |
Ces dispositions renforcent l'intérêt à transférer la gestion interne de l'expertise aux ressources humaines. Cela devrait permettre par ailleurs de disposer d'indicateurs de mesure plus fiables de l'activité de l'expertise externe .
Ainsi, dans le cadre d'un programme de travail défini par le directeur général, le département expertise la procédure actuelle de gestion des experts et rapporteurs qui collaborent dans les commissions et groupes de travail attachés à l'établissement. Une nouvelle procédure, intégrant la démarche actuelle complétée des pistes de progrès identifiées, devrait être soumise à l'été 2003 à l'ensemble des services administratifs concernés (agence comptable, direction de l'administration et des finances, cellule de veille déontologique et direction auprès de la direction générale). La place du département des ressources humaines est affirmée dans le cadre de cette nouvelle procédure puisqu'il s'inscrit dans un rôle de guichet unique. En effet, l'ensemble du dossier administratif de l'expert ou du rapporteur sera constitué auprès du département avant traitement par les services concernés. Ainsi les déclarations d'intérêt seront centralisées par le département avant traitement par la cellule de veille déontologique.
Le travail préparatoire au transfert de la gestion des experts externes au DRH est préparé par la cellule de veille déontologique et les directions opérationnelles.
Par ailleurs, une réflexion à moyen terme plus systématique sur le recours à l'expertise externe doit être engagée par l'Agence , même si ces réflexions ont déjà été engagées dans certains cas, avec la mise en place de procédures pour la commission de matériovigilance. Ces procédures permettent une évaluation ou un classement statistique d'incidents mineurs par l'unité de matériovigilance, et un désencombrement des sous-commissions techniques ou la commission nationale de matériovigilance.
En raison des enjeux en cause, le respect des règles de déontologie est particulièrement important au sein de la commission d'AMM.
|
Fonctionnement de la commission d'AMM et déontologie La nouvelle commission d'AMM a été nommée par le ministre au début du mois de juillet 2003, les membres nouvellement nommés représentant 40 % des membres proposés. Dans le domaine de la déontologie, et des conflits d'intérêt pour les experts, membres des groupes de travail de l'AMM et/ou membres de la commission d'AMM, il convient de souligner que des actions correctrices ont déjà été entreprises ou devraient prochainement être mises en place : - la liste exhaustive des experts amenés à travailler pour l'Agence, dans les différents groupes de travail, a été établie et fait l'objet d'une décision du directeur général publiée au bulletin officiel du ministère de la santé. Le directeur général a demandé qu'à partir de cette liste, une vérification systématique soit réalisée pour s'assurer de la complétude de la base FIDES pour toutes les commissions et groupes de travail de l'Agence. Cette vérification est facilitée par l'élargissement des autorisations d'accès à la base pour l'ensemble des secrétariats des commissions de l'Agence. Ceci devrait permettre d'assurer que l'ensemble des experts, membres des commissions et rapporteurs des groupes de travail, participant aux travaux de l'Agence sont effectivement inscrits, et les déclarations d'intérêts vérifiées, avant la fin du mois de juin 2003 ; - pour harmoniser les pratiques entre les différents départements ou unités de la direction de l'évaluation des médicaments et des produits biologiques de l'Agence en matière de vérification des conflits d'intérêts pour les experts/rapporteurs, en plus de la vérification lors de l'attribution du dossier au rapporteur, il est prévu de mettre en place, pour les nouveaux groupes de travail qui prendront leurs fonctions avec la nomination de la nouvelle commission d'AMM, une procédure de déclaration systématique des conflits d'intérêts au début de chaque groupe de travail. Pour cela, il sera demandé à chaque expert participant au groupe de travail, et/ou rapportant sur le dossier inscrit à l'ordre du jour du groupe de travail, de déclarer s'il estime avoir, ou non, un conflit d'intérêt direct ou indirect avec les produits cités. Cette déclaration sera portée à la connaissance du président de séance, avant l'ouverture des débats. Les règles de retrait, fixées par la cellule de déontologie, seront alors appliquées. Enfin, les feuilles de déclaration seront consignées et annexées aux procès-verbaux des groupes de travail. Il reste que parfois, comme l'a indiqué l'AFSSAPS elle-même, « compte tenu de la spécificité de la question à traiter, il n'ait pas été possible d'identifier un expert sans aucun conflit d'intérêt vis-à-vis du produit ou de la question analysée ». Dans ce cas, la déclaration la plus précise devra être faite, dûment consignée et le président de séance devra formellement annoncer aux membres du groupe l'existence de conflit d'intérêt. Cette procédure sera inscrite dans le règlement intérieur des commissions. Enfin, à l'occasion de la nomination de la nouvelle commission d'AMM, il devrait être précisé que la participation de représentant du LEEM 30 ( * ) soit envisagée au cours des séances plénières de la commission d'AMM, pour leur information et participation aux débats sur les questions générales ayant attrait aux médicaments. En revanche, chaque fois qu'un vote formel devra être prononcé sur un médicament en examen par la commission, il serait demandé au représentant de quitter la salle. |
4. En matière d'information et de communication
La Cour des comptes avait considéré que l'information demeurait, d'une manière générale, le point faible de l'AFSSAPS, la culture de base de ses agents étant une culture scientifique centrée sur la sécurité.
Elle estimait, d'une part, le système informatique n'était pas de bon niveau. L'absence de schéma informatique et la coexistence de différents systèmes hérités des différentes administrations ayant abandonné certaines de leurs compétences au profit de l'Agence ont conduit à un véritable « bricolage », qui a, en partie, expliqué le retard pris en matière d'indicateurs d'activité et de contrôle de gestion.
D'autre part, le secrétariat de la commission de la transparence, composé d'une douzaine de personnes, était, selon la Cour des comptes, beaucoup trop insuffisant pour remplir ses missions. Or, le passage d'un dossier devant la commission de la transparence constitue la première étape de la procédure du remboursement d'un médicament, après l'autorisation de mise sur le marché mais avant la fixation du prix par le comité économique des produits de santé (CEPS). Cette lacune du secrétariat de la commission de transparence serait une des causes de l'absence d'évaluation des dépenses des médicaments ou des dispositifs médicaux 31 ( * ) .
La Cour des comptes avait indiqué à votre rapporteur que, au début 2002, l'AFSSAPS, selon une enquête d'opinion menée auprès du corps médical, occupait la 16 ème place, sur 20, en termes de source d'informations pour les médecins !
De surcroît - et la Cour des comptes y voyait avec raison un étrange paradoxe - l'Agence avait également été chargée du secrétariat du Fonds de promotion de l'information médicale et médico-économique (FOPIM), créé par l'article 47 de la loi de financement de la sécurité sociale pour 2001. Il peut paraître curieux de confier le secrétariat d'un tel dispositif à un organisme dont le système d'information est en soi lacunaire.
Or, sur chacun de ces trois points, votre rapporteur a pu constater que l'AFSSAPS avait accompli des progrès notables, en particulier en matière de plus grande transparence de ses décisions.
a) Un système informatique en cours d'amélioration
Au cours des deux dernières années, l'Agence a consacré un effort particulier au renforcement des moyens humains du département des systèmes d'information et de la documentation (DSID).
En effet, comme l'Agence l'a elle-même noté, « le développement des projets informatiques [...] a été fortement entravé dans les années 2000-2001 par les difficultés de recrutement qui ont limité les possibilités de structuration du DSID ».
En 2003, tous les recrutements du DSID devraient être effectifs. Un poste de concepteur-développeur a été transféré de l'unité projets à la cellule d'informatique médicale. L'unité projets compte 13 agents en 2003.
Les concepteurs-développeurs intégrés en 2002, pour la moitié des jeunes diplômés de MIAGE 32 ( * ) , sont aujourd'hui opérationnels sur des projets concrets tels la migration CODEX, le développement de l'Intranet, la rénovation de l'application ATU (Autorisation Temporaire d'Utilisation) ou encore la mise en place de l'application NDS ( National Database System ) pour la gestion des psychotropes et stupéfiants.
Deux chefs de projets seniors ont été recrutés pour prendre en charge des projets prioritaires tels que la pharmacovigilance, en juin 2003, le suivi de dossier et le référentiel administrés. Un développeur-concepteur est venu renforcer l'unité projet sur le pôle développement.
Selon l'Agence, « cette structuration et le renforcement de ces moyens étaient une étape indispensable pour maintenir et développer le parc applicatif de l'AFSSAPS et consolider l'infrastructure informatique et les réseaux ».
Concernant les moyens financiers et les marchés, le marché d'infogérance bureautique, publié le 13 août 2002, a été notifié le 31 décembre 2002. La prestation a démarré le 3 mars 2003, et, d'après l'Agence, serait appréciée par les utilisateurs qui sont satisfaits d'un accueil téléphonique de 8 heures à 19 heures et qui voient leurs demandes référencées et traitées dans des délais raisonnables. Un bilan est prévu après trois mois d'activité. Il mesurera le volume des appels, leur délai de traitement et l'efficacité du service apporté.
L'Agence a estimé que « la mise en place d'un marché pour l'acquisition de matériels standards est à terme souhaitable mais n'est pas une priorité ».
Concernant les équipements et infrastructures informatiques, l'Agence a une politique de standardisation et d'industrialisation. Deux commandes par an sont lancées pour garantir une homogénéité des modèles achetés, ordinateurs et imprimantes. Cette standardisation du parc permet de gérer un nombre limité de configurations et de maîtriser les équipements acquis. Pour optimiser les coûts de maintenance des matériels hors garantie constructeur, le cycle de vie des équipements a été fixé à trois ans.
Fin mars 2003, les liaisons informatiques de Lyon et de Vendargues ont été modifiées pour passer à une puissance 15 fois supérieure. Cette opération rend possible l'utilisation des applications de l'Agence par les utilisateurs des sites déconcentrés. Elle permet également d'offrir à tous les agents, quelque soit leur localisation géographique, la même qualité de service au niveau de l'accès à Internet et Intranet, exception faite du site de Londres.
Le câblage du site Pleyel est terminé, les équipements réseau du site ont été changés. Le réseau local est maintenant disponible 24 heures sur 24, et sa bande passante nominale a été multipliée par 10. Une nette amélioration des temps de réponses serait constatée par les utilisateurs et le SVP informatique ne recevrait plus d'appels liés à la qualité du câblage et aux performances du réseau local.
Une opération de remise à niveau de la configuration des serveurs (standardisation des systèmes, mise à jour des versions logiciels, rationalisation des configurations) a été opérée sur tous les sites de février à mars 2003. Une attention particulière a été portée au niveau de la sécurité informatique pour préparer l'audit sécurité qui sera conduit par les services du Premier ministre au cours du second semestre.
Les projets informatiques ainsi qu'un calendrier de mise en oeuvre ont été discutés au cours des comités directeurs informatiques d'octobre 2002 et de l'année 2003. Ils comprennent :
- des applications informatiques à moderniser : les applications développées par les utilisateurs ont été recensées et sont en cours de qualification par les correspondants informatiques des directions. Elles seront graduellement prises en charge par le DSID, en fonction des ressources disponibles et de l'avancement des projets. Quelques applications seront totalement revues dans le cadre d'un projet plus large. Le projet Pharmacovigilance est identifié comme prioritaire, un chef de projet senior a été recruté en juin 2003 pour le conduire ;
- une politique informatique globale pour l'Agence : lors du comité de direction informatique du 30 avril 2003, le directeur général a confirmé que la réflexion sur un schéma directeur des systèmes d'information de l'Agence devrait être conduite en deux temps : développement pragmatique d'applications (pharmacovigilance, suivi de dossier, les référentiels...) puis élaboration d'un schéma directeur. Il convient de noter que le projet de migration de CODEX est en cours et devrait être terminé pour la rentrée de septembre 2003. Les applications satellites sont modifiées pour prendre en compte la nouvelle structure des tables de référence et l'identifiant unique de spécialité pharmaceutique (IUSP). La mise en oeuvre de l'IUSP dans CODEX a des enjeux internes et externes : elle permettra de reconnaître de manière univoque une spécialité pharmaceutique et facilitera l'interopérabilité des systèmes de l'Agence (pharmacovigilance, suivi de dossier, essais cliniques, outil de gestion des analyses...) et des systèmes extérieurs à l'AFSSAPS (prescription automatisée, pharmacovigilance...). Les applications développées dans le cadre de nouveaux projets (pharmacovigilance, suivi de dossier) utiliseront le référentiel CODEX. Cette politique générale d'utilisation de référentiels est renforcée par la construction progressive de nouvelles banques de données (administrés, dispositifs médicaux, réactifs, cosmétiques) garantissant l'unicité et la cohérence des données du système d'information de l'Agence ;
- la communication électronique avec l'extérieur : la mise en place d'échanges électroniques bidirectionnels entre l'Agence et les professionnels de santé au sens large (organismes nationaux, instances européennes, industriels, associations, usagers...) se fait progressivement avec l'évolution de la réglementation. Une première étape a été franchie avec les fiches d'incidents transfusionnels et avec la transmission des effets indésirables à l'Agence européenne du médicament. La mise en place d'échanges électroniques impose une modification des outils mais surtout une adaptation de l'organisa tion ;
- les référentiels électroniques : un projet d'élargissement du référentiel CODEX aux données cliniques a été examiné lors du comité de direction informatique du 30 avril 2003. Son lancement est prévu début 2004. Par ailleurs, un projet de remise à jour de l'ensemble des résumés des caractéristiques des produits des AMM de médicaments est en cours de finalisation. L'objectif fixé par le directeur général est de disposer des résumés au début 2004. La réalisation de ce projet nécessitera le recours à une prestation externe.
b) La politique de communication de l'AFSSAPS
La mission de communication mise en oeuvre à la création de l'AFSSAPS est devenue une cellule de communication en 2001. Cette cellule comprend une équipe de 4 personnes.
Le budget global de communication s'est élevé en 2002 à 253.700 euros, dont 115.000 euros ont été affectés au poste édition.
• La communication externe
La politique de communication externe de l'AFSSAPS repose sur une double orientation : assurer la lisibilité de l'activité en matière de sécurité sanitaire des produits de santé et mieux faire connaître le rôle et les missions de l'Agence. Elle se traduit par la diffusion d'informations sur le bon usage des produits de santé (évolution du rapport bénéfice/risque), l'élaboration et la diffusion de recommandations de bonnes pratiques (synthèse de l'expertise sur un produit ou une classe de produits), la diffusion de messages d'alertes sur les défauts de qualité (non conformité des produits de santé) et l'organisation de manifestations thématiques ou à vocation transversale sur les dossiers traités et la démarche d'expertise.
Les publics concernés sont essentiellement les professionnels de santé, médecins et pharmaciens, relais de l'information auprès des patients et associations de patients, avec pour objectif la lisibilité des mesures prises par l'Agence.
Dans le domaine du médicament, les professionnels de santé, médecins et pharmaciens, sont régulièrement destinataires de courriers d'information sur le bon usage des médicaments, faisant notamment suite à l'actualisation des données de pharmacovigilance.
En 2002, plus d'une trentaine de Lettres aux prescripteurs ont été diffusées aux médecins ou pharmaciens concernés, directement par l'AFSSAPS ou par le biais de l'industrie pharmaceutique sur la base d'une information validée. Par ailleurs, des mises au point sur des aspects ciblés de santé publique sont élaborées chaque année et diffusées aux professionnels de santé. Elles s'inscrivent dans le cadre de la démarche d'information sur la iatrogénie médicamenteuse issue des travaux d'expertise des sous-groupes de la commission nationale d'autorisation de mise sur le marché et d'études épidémiologiques menées avec le concours des CRPV (antivitamines K, héparines de bas poids moléculaire...) ou font la synthèse des travaux des groupes de travail de l'AFSSAPS (utilisation de l'hydrate de chloral, expertise DHEA, psychoactifs et soumission chimique, actualisation de l'information sur Distilbène...). Enfin, les modifications apportées à l'autorisation de mise sur le marché, à l'échelon européen, sont également relayées aux professionnels de santé dans le cadre d'actions de communication menées à une date arrêtée par l'ensemble des Etats membres (contraceptifs oraux de 3 ème génération...). Par ailleurs, les recommandations de bonnes pratiques sont disponibles sur le site Internet de l'Agence et font l'objet de publications dans des revues scientifiques.
Dans le domaine des dispositifs médicaux, les mesures prises par l'Agence après évaluation des signalements de matériovigilance sont régulièrement relayées aux correspondants de matériovigilance implantés dans les établissements de soins. Par ailleurs, une rubrique matériovigilance, mise en place en 2000 sur le site Internet de l'Agence, apporte des informations pratiques aux correspondants de matériovigilance et fabricants de dispositifs médicaux, et regroupe toutes les mesures de sécurité sanitaire prises par l'Agence.
Celle-ci publie depuis trois ans des périodiques d'information destinés aux réseaux de vigilance. Ces bulletins, Vigilances ou Hémovigilance , permettent d'assurer un retour d'information et de répondre aux attentes de ces réseaux, en rendant plus lisibles certaines des actions menées ou des décisions prises par l'Agence. L'information sur les vigilances devrait être renforcée en 2003 par la diffusion d'un bulletin destiné au réseau de matériovigilance.
Outre ces publications, l'AFSSAPS organise régulièrement des colloques et réunions d'information pour des publics externes, soit dans le cadre de réunions d'experts (environnement sanitaire des tissus, secrétariats nationaux de la pharmacopée européenne, inspection des fabricants de dispositifs médicaux, DHEA...), soit dans un but institutionnel d'information sur le rôle et les missions de l'Agence (les Journées de l'AFSSAPS).
Par ailleurs, l'Agence est présente sur des congrès scientifiques ou des salons professionnels, à la fois dans le cadre d'interventions, par la production de posters scientifiques et par la présence de son stand (Journées Internationales de Biologie, Congrès Hémovigilance, Journées Françaises de Radiologie...).
Le domaine des relations avec les médias se caractérise par la diffusion chaque mois, de deux à trois communiqués de presse sur des sujets concernant au premier chef l'évolution du rapport bénéfice/risque des médicaments. Parallèlement, l'Agence organise chaque année trois à quatre conférences de presse à l'issue de démarches d'évaluation (ESST et produits de santé, risque musculaire des statines, traitement hormonal substitutif de la ménopause...). Ces opérations de presse interviennent systématiquement après l'information relayée aux professionnels de santé.
|
Bilan 2001/2002 du site Internet de l'AFSSAPS Le site Internet de l'AFSSAPS ( www.afssaps.sante.fr ) avait été créé en décembre 1998 pour l'Agence du médicament. Il a subi une profonde mutation pour fournir aux professionnels de santé, aux usagers et aux industriels, une information de référence sur les produits de santé, diffuser les alertes de sécurité sanitaire et contribuer à la promotion du bon usage des produits de santé. Il constitue un moyen incontournable de communication pour l'AFSSAPS. Le site permet aujourd'hui de diffuser de nombreux documents techniques et scientifiques, les alertes de sécurité sanitaires prises à l'initiative de l'AFSSAPS, les lettres aux prescripteurs, les communiqués de presse. Des dossiers thématiques sont également proposés ainsi que le rapport annuel d'activité. Par ailleurs le site s'est enrichi de la mise en consultation des avis de la commission de la transparence, en 2001, du répertoire des spécialités pharmaceutiques et du répertoire des essais cliniques, en 2002. Fin 2002, une liste de diffusion électronique a été ouverte au public, permettant aux personnes inscrites d'être informées de toute nouvelle information mise en consultation. Les objectifs actuels du site sont : - fournir aux professionnels de santé, aux usagers, aux industriels, une information de référence sur les produits de santé ; - diffuser les alertes de sécurité sanitaire de l'AFSSAPS ; - contribuer à la promotion du bon usage des produits de santé ; - simplifier les démarches des professionnels de santé et des industriels dans leurs relations avec l'établissement (guides de remplissage des dossiers et formulaires de déclaration de demandes d'autorisation). L'accès du site est libre et aucune forme d'inscription n'est nécessaire. Pour piloter cette mission, une cellule Internet a été créée en 2001. Elle est placée à la direction générale et est composée d'un coordinateur, de deux webmasters et d'une secrétaire à mi-temps. Un comité éditorial a été mis en place pour assurer la pertinence et la cohérence des informations publiées sur le site Internet. |
Le nombre de visiteurs du site Internet est en constante augmentation depuis 1998. Il a été multiplié par 3,5 entre 2000 et 2002, avec, en décembre 2002, une moyenne de 5.000 visiteurs par jour ouvré.
|
|
Fréquentation du site Internet de l'AFSSAPS
|
2001 |
2002 |
Variation |
|
|
Pages vues |
2.700.000 |
6.300.000 |
+ 130 % |
|
Visites |
625.000 |
1.000.000 |
+ 60 % |
|
Visiteurs/jour ouvrable |
3.000 |
5.000 |
+ 67 % |
Source : AFSSAPS
Exemple de pages les plus fréquentées
(en nombre de pages vues)
|
2001 |
2002 |
|
|
SMR (140 pages) (mise en ligne le 7 juin 2001) sommaire cardio |
1.523/jour 109/jour 114/jour |
700/jour 25/jour 40/jour |
|
Fiches de transparence |
200/jour (pour les 41 fiches) |
300/jour (pour les 41 fiches) |
|
Avis de la transparence (mise en ligne le 17 septembre 2001) liste alphabétique liste chronologique |
107/jour 88/jour |
115/jour 103/jour |
|
Ruptures de stock (depuis 1 er oct. 2002) |
- |
50/jour |
Source : AFSSAPS
En 2002, chaque communiqué de presse a été consulté en moyenne 2.800 fois. Chaque offre d'emploi a été consultée en moyenne 1.700 fois. Chaque lettre aux prescripteurs a été consultée en moyenne 1.500 fois. Chaque alerte a été consultée en moyenne 1.400 fois.
Rapports les plus téléchargés en 2001 et 2002
|
2001 |
2002 |
|
|
Répertoire des génériques |
4.000 |
8.000 |
|
Fiches biotox |
9.700-3.400 |
- |
|
Bonnes pratiques de pharmacovigilance |
2.280 |
5.800 |
|
Rapport DHEA |
4.787 |
5.700 |
|
Déclarations publiques d'intérêts |
- |
4.900 |
|
Rapport vente des médicaments |
4.020 |
4.800 |
|
Bulletin des vigilances 7 |
2.350 |
- |
|
Bulletin des vigilances 8-9 |
- |
5.000 |
|
Bulletin des vigilances 10-11 |
- |
3.500 |
|
ATU (doc. d'information) |
- |
4.700 |
|
Rapport vaccination anti hépatite B |
1.656 |
2.700 |
|
Rapport cérivastatine |
1.395 |
3.500 |
|
Divers rapports/recommandations |
1.500-2000 |
Source : AFSSAPS
La deuxième partie de l'année 2002 a été marquée par la mise en ligne de deux bases de données interrogeables par les internautes :
- le répertoire des spécialités pharmaceutiques qui est consulté 180 fois par jour ;
- le répertoire des essais cliniques sur les maladies rares/graves, qui reçoit quotidiennement une centaine de visites.
En fin d'année, a été ouverte au public une liste de diffusion permettant aux internautes qui le souhaitent de s'inscrire pour être informés dès la mise à disposition d'une nouvelle information sur le site Internet. Cette liste a été testée pendant l'été 2002, auprès de 300 professionnels de santé volontaires.
Les principales demandes d'ajustement souhaité par les premiers utilisateurs ont été prises en compte avant l'ouverture au public le 2 décembre 2002. Fin février 2003, plus de 4.000 personnes étaient inscrites.
Depuis le 1 er janvier 2003
Rapport d'activité 12.000 téléchargements
Monographie DHEA : 9.300 téléchargements
Liste des spécialités indiquées dans le THS 9.200 téléchargements
Répertoire des génériques 8.200 téléchargements
La reprise dans des articles de presse des informations résultant des manifestations organisées auprès des médias ou des communiqués diffusés est en progression. Depuis un an, l'Agence est systématiquement citée dès lors que la presse fait état d'une information relative à la sécurité sanitaire des produits de santé.
L'impact de l'information diffusée auprès des professionnels de santé est, à ce jour, qualitativement mesurée par le biais des courriers adressés et des contacts téléphoniques auprès de la cellule de communication. Selon l'Agence, « dans la plupart des cas, les professionnels font état de leur satisfaction sur l'information, mais souhaitent néanmoins que des améliorations soient apportées à la forme, jugée trop administrative . Un dispositif de mesure systématique d'impact, en particulier sur les pratiques professionnelles, serait en cours de mise en oeuvre. Par ailleurs, au cours de l'année 2001, le bulletin Vigilances s'est vu adjoindre des pages complémentaires devant l'adhésion qu'il emportait auprès des professionnels de santé ».
S'agissant des perspectives de la politique de communication en 2003 et 2004, l'AFSSAPS est sur le point de se doter d'un nouveau logo reflétant son aspiration à afficher une plus grande ouverture vers ses différents publics avec une identité graphique plus forte.
Par ailleurs, elle organise, en 2003, ses 2 èmes Journées dans un format nouveau, axé sur la volonté de mieux expliquer son rôle, ses missions et son actualité à travers des illustrations concrètes susceptibles de répondre aux attentes des différents publics sollicités (professionnels, institutionnels, presse, associations).
Ces deux dossiers majeurs entrent dans le cadre de la stratégie de communication élaborée pour 2003 et 2004, pour laquelle l'AFSSAPS recourt aux prestations d'une agence de conseil en communication.
Dans ce cadre, plusieurs outils de communication existants, notamment les bulletins d'information, feront l'objet d'une expertise portant sur la pertinence et l'impact. De même, les relations avec la presse seront renforcées par la mise en oeuvre de points d'information sur les sujets techniques de l'Agence ou autour de grandes thématiques de santé.
En termes de fonctionnement, un nouveau marché d'édition sera opérationnel au cours du 2 ème trimestre 2003. Il permettra d'introduire de nouveaux outils de communication, notamment une news letter institutionnelle et une brochure de synthèse des données d'activité de l'Agence, ou de concevoir de nouveaux repères visuels pour les informations diffusées aux professionnels de santé.
• Communication interne
La communication interne de l'Agence s'appuie sur trois orientations : informer le personnel sur l'Agence et son environnement, favoriser l'échange d'informations au sein de l'établissement, assister l'ensemble des directions en proposant et en élaborant, à leur demande, des outils de communication adaptés.
Dans ce cadre sont élaborées et diffusées des informations de nature pratique ou sociale (organisation, règles à respecter...), des informations sur l'actualité de l'Agence (communiqués et points presse, réunions, séminaires, colloques...), des informations sur les ressources humaines (réforme statutaire et 35 heures...). Sur ce dernier point, sont également organisés des « rendez-vous du personnel ». Dans le même ordre d'idées, certaines des manifestations organisées pour un public externe font l'objet de présentation à l'identique, pour le public interne de l'Agence. Parallèlement, le personnel dispose, via Intranet, d'une lettre bimestrielle d'information comportant un dossier thématique central. Par ailleurs, 2 à 3 journées sont organisées annuellement pour les nouveaux collaborateurs de l'Agence.
L'AFSSAPS a mis en place en 2002 le premier niveau de plate-forme technique de l'outil Intranet, projet conduit en coordination avec le département des systèmes d'information. Le développement de cet outil (organisation, fonctionnement, charte graphique) est en cours de réflexion.
Le rapport d'activité de l'AFSSAPS a subi, depuis 2 ans, de profondes modifications de forme et de fond pour mieux refléter et illustrer l'activité de l'établissement. Cette orientation se traduit par des demandes d'informations nouvelles auprès des différentes directions de l'établissement, notamment l'introduction d'un plus large volume de données qualitatives.
c) Le projet @MM
L'article 47 de la loi de financement de la sécurité sociale pour 2001 avait confié à l'AFSSAPS la gestion du fonds de promotion de l'information médicale et médico-économique (FOPIM), lequel finance ou participe au financement d'actions d'information et de communication en matière de bon usage des produits de santé et de stratégie thérapeutique, notamment de prescription et de dispensation médicamenteuse. Le décret régissant le fonctionnement du FOPIM a été pris le 21 novembre 2001, et complété par la nomination de personnalités qualifiées en mars 2002.
|
Les activités du FOPIM Le FOPIM, avec la collaboration d'un groupe de praticiens de terrain, a réalisé deux enquêtes sur les besoins d'information des prescripteurs, dont une plus spécifiquement axée sur l'outil Internet. Il a en outre contribué au volet concernant les professionnels de santé de la campagne d'information sur les médicaments génériques. Enfin, il a mis en place un groupe de travail sur les bases de données médicament et les logiciels d'aide à la prescription et lancé un appel à subvention pour des revues indépendantes. Le comité d'orientation du fonds, au cours de sa réunion du 17 juin 2003, a adopté les délibérations concernant ces deux derniers projets, permettant ainsi leur réalisation pratique. |
La même disposition législative fixait à l'AFSSAPS la mission de mettre en oeuvre, d'ici au 1 er janvier 2003, une banque de données administratives et scientifiques sur les médicaments et les dispositifs médicaux, destinée à servir de référence pour l'information des professionnels de santé et des administrations compétentes en matière de produits de santé.
Dans ce cadre, l'AFSSAPS a conçu le projet @MM qui a pour objectif la publication sur son site Internet des décisions d'autorisations de mise sur le marché, avec le résumé des caractéristiques du produit et la notice destinée aux patients. Le nombre de spécialités pharmaceutiques concernées est d'environ 15.000.
Demande récurrente des professionnels de santé, le projet @MM s'inscrit aussi, pour l'AFSSAPS, dans une démarche de transparence en matière de publication et de diffusion de ses décisions administratives.
Il n'en reste pas moins que cette disposition de la loi de financement de la sécurité sociale pour 2001 illustre bien la tentation des pouvoirs publics de mettre à la charge de l'Agence des missions nouvelles alors qu'elle est par ailleurs confrontée aux difficultés inhérentes à la transformation de l'ancienne Agence du médicament et à sa montée en puissance.
Du reste, l'Agence a dû mobiliser des moyens spécifiques pour développer ce projet :
- le mode de production des décisions d'AMM a été réorganisé, parallèlement à la restructuration de la direction de l'évaluation des médicaments et des produits biologiques de l'établissement : leur rédaction a été centralisée et des outils d'aide à la rédaction mis à disposition ;
- 15 pharmaciens ont été recrutés pour une durée de 10 mois au début 2002 pour contrôler la concordance des données contenues dans la base CODEX, base de données interne sur le médicament de l'AFSSAPS, avec celles figurant sur les documents princeps des archives de l'Agence ;
- le recours à une société de services en ingénierie informatique pour développer l'application Web ;
- la mise en place d'une structure traditionnelle de projet impliquant différentes directions de l'Agence au sein d'un comité de pilotage.
Toutefois, comme l'a indiqué l'Agence à votre rapporteur, « le scénario préconisé par l'étude de faisabilité initiale a privilégié une mise à disposition progressive de ces données », ce qui revient à dire que la mise en oeuvre du projet a pris du retard .
En effet, si le répertoire des spécialités pharmaceutiques a été mis à disposition sur le site Internet de l'AFSSAPS le 17 juin 2002, soit avant le délai du 1 er janvier 2003 fixé par le législateur, c'est une version « allégée » de ce répertoire qui a été rendue accessible :
- le contenu de la base de données en ligne est un sous-ensemble des informations contenues dans la base de données CODEX ; il se présente sur le site sous la forme d'un extrait , soit la fiche récapitulant les données administratives, réglementaires et pharmaceutiques de la spécialité pharmaceutique ; cet extrait est toutefois actualité en fonction des décisions modificatrices émises par l'AFSSAPS ;
- le contenu de la banque documentaire en ligne est un sous-ensemble des informations contenues dans les AMM : résumé des caractéristiques du produit et notice ; les spécialités pharmaceutiques sont celles qui ont été octroyées depuis le 1 er janvier 2002 ; elles sont mises à jour régulièrement.
En outre, la mise en place d'un référentiel complet s'est heurtée à plusieurs obstacles :
- l'hétérogénéité du fonds documentaire, marquée par la prédominance de documents sur support papier et l'existence de formats électroniques différents ;
- l'évolution peu cohérente de la structure administrative des décisions d'AMM ;
- l'absence de logiciel de gestion électronique de documents ;
- la qualité, présumée insuffisante par l'AFSSAPS elle-même, du contenu des bases de données existantes ;
- le périmètre insuffisant des informations enregistrées dans les bases de données existantes, en particulier l'absence de données cliniques dans Codex ;
- une équipe de gestion des bases de données sous-dimensionnées.
A la mi-mars 2003, le site Internet de l'Agence présentait les extraits de 10.442 spécialités pharmaceutiques, 443 résumés des caractéristiques du produit et autant de notices.
D'une manière générale, il convient de constater que la multiplicité des acteurs institutionnels ayant vocation à communiquer auprès des médecins et du grand public (AFSSAPS, ANAES, caisses d'assurance maladie, INPES, ministère de la santé, commission de la transparence, FOPIM) a conduit le ministère à en souhaiter une rationalisation .
Selon l'Agence, « compte tenu de la réforme de la commission de la transparence en cours, il pourrait être envisagé de rapprocher le FOPIM de cette dernière. Le secrétariat du FOPIM devra dans ce cadre rester proche de celui de la commission de la transparence, ce que devrait permettre l'organisation actuelle, puisque les activités relatives au FOPIM et à la commission sont regroupées au sein d'une même direction de l'AFSSAPS ».
B. UNE ÉVALUATION DES ACTIVITÉS DE L'AGENCE INSUFFISAMMENT TOURNÉE VERS L'EFFICACITÉ
Actuellement, l'AFSSAPS mesure davantage ses activités que son efficacité. Si, comme elle l'a elle-même noté, « l'efficacité peut se définir comme le niveau de sécurité sanitaire que l'Agence procure au public entendu au sens large (patients, usagers, professionnels...) », elle n'est pas encore véritablement en mesure de la définir.
Les réponses que l'AFSSAPS a apportées sur ce point à votre rapporteur le confirment. Elle a ainsi indiqué qu'elle pouvait rendre compte « d'une importante « activité » dans son environnement et d'un nombre croissant de questions traitées avec toute la rigueur scientifique et techniques indispensables », ce qui est particulièrement succinct. Elle renvoie certes aux indicateurs présentés dans ses rapports d'activité, mais ceux-ci sont essentiellement d'ordre quantitatif. L'Agence a d'ailleurs implicitement reconnu ce fait puisqu'elle a noté que « l'ensemble des interventions et actions de l'Agence font l'objet d'un recensement ». Il s'agit bien, en effet, d'un recensement, et non d'une évaluation. Elle cite d'ailleurs elle-même des exemples : nombre d'AMM, nombre d'autorisations temporaires d'utilisation, nombre d'observations d'effets indésirables dans le domaine des vigilances, nombre de demandes traitées au titre de la transparence et de la publicité, nombre d'établissements contrôlés et de décisions, prises à la suite de ces inspections, nombre d'analyses réalisées par les laboratoires...
L'Agence a ainsi indiqué à votre rapporteur que, « concernant les indicateurs de suivi d'activités, le directeur général n'a jamais caché que l'exercice, qualifié de pertinent et de démarche nouvelle pour l'Agence dans le rapport d'audit IGF/IGAS, d'élaboration d'indicateurs en 2001 n'est qu'une ébauche à partir des données d'activité, certes imparfaite, et d'une estimation des ressources humaines consacrées à ces activités ».
Le travail actuel le plus important repose sur la mise en place d'indicateurs opérationnels, bien qu'il soit difficile d'appréhender globalement l'efficacité des actions d'une agence dont le champ d'intervention n'a cessé de croître .
Néanmoins, des points importants ont déjà été déterminés :
1) Le but est de lier les moyens aux objectifs et de déterminer les priorités en fonction des ressources disponibles.
Les indicateurs développés visent à quantifier, lorsque c'est possible, l'activité de l'Agence. Ils permettent d'évaluer ex ante les moyens nécessaires et de définir ainsi les objectifs accessibles en fonction des priorités et des obligations. Ex post , ils permettent de confirmer l'évaluation et de modifier, le cas échéant, les orientations.
Les tableaux de bord proposés et les indicateurs qui les composent visent ainsi à objectiver le travail de l'Agence :
- dans une approche globale, permettant une compréhension de l'activité générale de l'Agence et facilitant le travail des administrateurs et des ministères de tutelle ;
- en permettant également une analyse plus fine à la demande, dans le cadre du pilotage interne à l'établissement.
2) Une logique de produit prédominant pour une meilleure lisibilité
L'établissement d'un projet de mesure de l'activité de l'Agence a été fait en tenant compte de deux logiques d'analyse de l'activité : une logique de produits et une logique par missions . Dans l'approche globale, le découpage premier est celui des produits, car il correspond aux attentes des professionnels de santé, des patients et des industriels.
L'ensemble des produits de santé pour lesquels l'Agence est compétente peuvent être identifiés et classés selon une catégorie générale d'appartenance, à savoir les médicaments, les dispositifs médicaux, produits biologiques, cosmétiques, et autres produits.
Les activités opérationnelles communes aux différentes directions de l'Agence ont été regroupées autour de six activités qui définissent à la fois les missions de l'Agence et les tâches communes aux différentes directions opérationnelles de celle-ci.
Il s'agit de : l'évaluation ; la vigilance et la gestion des alertes ; le contrôle des produits ; l'inspection ; la conception de la réglementation et des normes ; l'information et la communication.
3) Un choix d'indicateurs qui repose sur un principe de lisibilité
Plusieurs critères ont servi à sélectionner les indicateurs proposés :
• Des indicateurs simples et robustes
Les indicateurs proposés peuvent être renseignés en utilisant des données disponibles et leur recueil ne nécessite pas une adaptation importante du système d'informations. Par ailleurs, la lisibilité de l'évolution des résultats nécessite que les indicateurs définis soient stables dans le temps.
• Des indicateurs pertinents
Les indicateurs retenus donnent à voir la diversité des activités de l'Agence et doivent permettre de mettre en face de celles-ci les moyens ou ressources utilisés ou à mobiliser.
L'appropriation collective des indicateurs exige un accord de l'ensemble des utilisateurs sur leur pertinence, autrement dit que ces indicateurs soient significatifs au regard des missions et de l'activité.
• Des indicateurs interprétables
Les indicateurs sont explicables, c'est-à-dire que les données détaillées sur lesquelles ils sont fondés sont accessibles et que les résultats sont commentés.
• Des indicateurs qualitatifs
Les indicateurs portent sur les flux, mais également sur les performances, au premier rang desquelles le respect des délais impartis, qui constitue un facteur d'efficacité pour la sécurité sanitaire et qui est un service rendu aux industriels. Le délai moyen ou médian présente également un intérêt.
S'agissant des médicaments, des analyses spécifiques sont possibles. Sont d'emblée proposées des analyses sur les médicaments génériques. Sont également proposées des analyses sur les médicaments issus des biotechnologies.
Les activités quantifiées ne s'arrêtent pas à la seule activité opérationnelle de sécurité sanitaire, mais comprennent également la participation à la conception de textes, ainsi que l'activité d'expertise ou de conseil technique et scientifique à la DGS sur les domaines de son champ de compétence. Les activités européennes sont parties intégrantes du travail quotidien et seront quantifiées, en distinguant les cas où l'Agence est pilote au niveau européen, de ceux où elle est simple participante.
Il n'en demeure pas moins vrai que la tâche reste à accomplir et doit mobiliser l'encadrement supérieur de l'AFSSAPS. Ce travail est indispensable à la démarche d'un contrat d'objectifs et de moyens. L'objectif est de consolider une première série d'indicateurs à l'automne 2003 mais il est tout à fait évident que la mise en place d'indicateurs validés sera progressive et bénéficiera du développement d'outils informatiques tant pour le suivi budgétaire (ADIX) que pour les ressources humaines (CIRIL), qui avaient été planifiés et qui sont en fin de réalisation.
Cette démarche, comme l'ont rappelé les tutelles lors du conseil d'administration de mai 2003, ne peut se poursuivre qu'à partir des conclusions définitives du rapport de la mission IGF/IGAS. Le contrat d'objectifs et de moyens serait donc discuté fin 2003/début 2004. Le président et le conseil d'administration doivent s'impliquer dans la préparation du contrat avec les autorités de tutelle.
Votre rapporteur estime dès lors que le nouvel examen de la loi du 1 er juillet 1998 précitée devra prendre en compte les améliorations apportées par l'Agence à son fonctionnement, suite aux conclusions de cet audit.
EXAMEN EN COMMISSION
Réunie le mercredi 16 juillet 2003 , sous la présidence de M. Jean Arthuis, président , la commission a entendu une communication de M. Adrien Gouteyron, rapporteur spécial des crédits de la santé, de la famille, des personnes handicapées et de la solidarité , sur la mission de contrôle portant sur l'Agence française de sécurité sanitaire des produits de santé (AFSSAPS).
M. Adrien Gouteyron, rapporteur spécial , a indiqué que l'Agence française de sécurité sanitaire des produits de santé (AFSSAPS) était une autorité sanitaire déléguée, chargée d'assurer la protection de la santé publique pour l'ensemble des produits de santé, en particulier les médicaments, les dispositifs médicaux, les produits sanguins labiles, les organes, tissus, cellules et produits d'origine humaine ou animale, les produits de thérapie génique et cellulaire, les produits cosmétiques. Il a noté que l'AFSSAPS exerçait trois métiers principaux : l'évaluation, le contrôle et l'inspection. Il a précisé que la décision d'effectuer un contrôle de cette agence résultait de la diminution votée en loi de finances pour 2003 de la subvention que lui versait l'Etat, dont le montant était passé de plus de 25 millions d'euros à moins de 5 millions d'euros, en raison de l'importante trésorerie que l'Agence s'était constituée. Il a noté que l'AFSSAPS avait fait l'objet de plusieurs contrôles, puisque la Cour des comptes avait examiné les conditions de sa mise en place, tandis que l'Inspection générale des finances (IGF) et l'Inspection générale des affaires sociales (IGAS) terminaient un audit de l'établissement, préalable à la conclusion d'un contrat d'objectifs et de moyens. Enfin, l'Office parlementaire d'évaluation des choix scientifiques et technologiques, sur le rapport de M. Bernard Seillier, avait engagé une évaluation de l'application de la législation relative aux différentes agences sanitaires.
Il a rappelé que l'AFSSAPS était un établissement public placé sous la tutelle du ministre de la santé, créé par la loi du 1 er juillet 1998 qui avait également institué l'Agence française de sécurité sanitaire des aliments (AFSSA) et l'Institut national de veille sanitaire (InVS). Elle avait ainsi succédé à l'Agence du médicament, créée en 1993, et qui, elle-même, avait succédé à une direction d'administration centrale du ministère de la santé, le laboratoire national de la santé, apparu en 1950. Les missions de contrôle sanitaire des produits de santé avaient ainsi été assumées directement par l'Etat pendant plus de 40 ans, avant d'être déléguées à une agence.
Sur l'organisation administrative de l'AFSSAPS, M. Adrien Gouteyron, rapporteur spécial , a observé la participation assez médiocre des membres, ou de leurs représentants, du conseil d'administration et du conseil scientifique de l'Agence aux réunions de ceux-ci. Il a cité, à titre d'exemple, la direction de l'hospitalisation et de l'offre de soins du ministère de la santé qui n'avait participé à aucune réunion du conseil d'administration en 2002. Il a également indiqué que, entre février 2001 et mai 2002, 13 membres du conseil scientifique n'avaient jamais participé à plus de la moitié de ses réunions. Il s'est dès lors interrogé sur la véritable implication de certains des membres des conseils de l'Agence et, par conséquent, sur le rôle réel de ces instances. Il a ajouté que les procédures administratives relatives au fonctionnement des conseils étaient extrêmement longues, le conseil scientifique n'ayant plus de président depuis plus d'un an.
Il a ajouté que, bien que succédant à l'Agence du médicament, l'AFSSAPS disposait de missions beaucoup plus larges, définies, notamment, par l'article L. 5311-1 du code de la santé publique. L'Agence disposait de pouvoirs de police sanitaire étendus afin d'améliorer la prévention et la sécurité sanitaires : elle pouvait par exemple suspendre, voire interdire les activités concernant les produits entrant dans son champ de compétences. Elle disposait également d'importantes prérogatives en matière d'inspection, en particulier un pouvoir d'accès aux locaux professionnels et aux données ou encore un pouvoir de saisie et de consignation.
Il a indiqué que, pour l'exercice de ses missions, l'Agence avait recours à une expertise, interne et externe, abondante et parfois délicate à maîtriser. En effet, l'AFSSAPS pouvait éprouver des difficultés à s'assurer de l'indépendance de ses experts, même internes. Elle aurait ainsi embauché un agent provenant du secteur privé qui ne serait resté que huit mois, au cours desquels il aurait contrôlé les activités de l'entreprise concurrente de son entreprise d'origine, avant de retourner travailler au sein de cette dernière. Il a rappelé que pas moins de 14 commissions étaient placées dans l'orbite de l'AFSSAPS au titre de ses missions d'expertise, dont la commission d'autorisation de mise sur le marché (AMM) des produits relevant du champ de compétences de l'Agence, et la commission de la transparence, qui jouait un rôle déterminant dans l'évaluation du service médical rendu (SMR) des médicaments et donc dans la fixation de leur niveau de remboursement. Le problème de l'indépendance et de l'impartialité des experts externes de l'Agence se posait avec acuité, dans la mesure où il s'agissait le plus souvent de médecins, libéraux ou hospitaliers, et d'universitaires qui collaboraient plus ou moins régulièrement avec l'industrie pharmaceutique. Afin de prévenir tout risque déontologique, l'Agence s'était dotée d'une cellule de veille déontologique et ses collaborateurs extérieurs avaient l'obligation de remplir une déclaration publique d'intérêts mentionnant les liens, directs ou indirects, qu'ils pouvaient avoir avec les entreprises ou établissements dont les produits entraient dans le champ de compétences de l'Agence. Ces déclarations étaient rendues publiques sous la forme d'un rapport.
Toutefois, ces bonnes intentions s'étaient parfois heurtées aux faits. Ainsi, les notices du dictionnaire médical Vidal, financé par l'industrie pharmaceutique, étaient rédigées, le plus souvent, par des professionnels qui pouvaient siéger à la commission d'AMM. Il existait en ce cas un risque de conflit d'intérêt. Cette situation avait aussi longtemps tenu à « l'extrême frilosité » de l'Agence en matière de transparence de son système d'information médicale, en particulier la mise en ligne tardive des avis de la commission d'AMM. Du reste, ses supports d'information, rapports publics comme site Internet, avaient longtemps été pauvres en informations scientifiques vraiment intéressantes pour le monde médical.
M. Adrien Gouteyron, rapporteur spécial , a fait remarquer que la tutelle de l'Agence, assurée pour l'essentiel par la direction générale de la santé, mais aussi par la direction de l'administration générale, du personnel et du budget, pour les questions budgétaires et de personnels, était un exercice délicat. En effet, d'un côté, la DGS était à la fois juge et partie, puisque, tutelle de l'AFSSAPS, elle siégeait, avec droit de vote, à la commission de la transparence comme au comité économique des produits de santé (CEPS), où étaient discutés les prix des médicaments. D'un autre côté, l'Agence n'avait présenté à la DGS ni axes prioritaires d'actions ni objectifs hiérarchisés à poursuivre. Enfin, les relations entre la DGS et l'Agence n'avaient pas toujours été bonnes, ce qui avait conduit l'Agence à entretenir des relations directes avec le cabinet du ministre, rendant plus compliqué encore l'exercice de la tutelle par l'administration centrale, qui se sentait dès lors « court-circuitée ».
Il a considéré que les dysfonctionnements qui affectaient l'AFSSAPS résultaient avant tout d'une croissance des moyens mis à sa disposition plus rapide que sa capacité à les mettre correctement en oeuvre, l'Agence souffrant, en quelque sorte, d'une « crise de croissance ». Il a indiqué que l'AFSSAPS, depuis sa création, avait constitué une priorité budgétaire. Ainsi, entre 1999 et 2001, ses dépenses avaient progressé de près de 44 %, passant de 50,39 millions d'euros en 1999 à 72,50 millions d'euros en 2001. Si l'on s'en tenait aux prévisions des budgets primitifs pour 2002 et 2003, les dépenses de l'Agence devraient même s'établir, respectivement, à 97 millions d'euros et à plus de 123 millions. Depuis 1999, ses dépenses auraient alors augmenté de près de 145 %, et d'environ 27 % au cours du seul exercice 2002/2003. Il convenait néanmoins de relativiser ces chiffres en raison de la surestimation systématique des dépenses de l'Agence dans le budget primitif, en particulier les dépenses d'investissement.
Il a précisé que les recettes de l'Agence - 89 millions d'euros prévus en 2003 - voyaient depuis peu leur structure évoluer. La part des taxes, droits et redevances parmi ses recettes de fonctionnement, toujours supérieure à 50 %, avait tendance à augmenter régulièrement depuis deux ans et devrait même en représenter 82 % en 2003. Corollaire logique de cette évolution, la part de la subvention de l'Etat n'avait cessé de diminuer : elle était passée de 27,81 millions d'euros en 2000, soit 40,6 % des recettes de fonctionnement - son point le plus haut - à moins de 5 millions d'euros en 2003, soit 8 % des recettes. En fait, ce mouvement résultait d'une interrogation de fond sur la véritable utilité d'une telle subvention pour l'équilibre financier de l'Agence. Du reste, le taux de consommation des crédits était parfois peu élevé, ce qui donnait lieu à de substantiels reports.
Il a considéré que, si l'Agence avait vu ses moyens croître très sensiblement depuis 1999, ses outils de gestion étaient demeurés frustes. Le contrôle de gestion n'existait pas : par conséquent, l'Agence ne pouvait évaluer avec précision ses activités au regard d'indicateurs de performances solidement établis. La lecture des procès-verbaux des séances du conseil d'administration montrait d'ailleurs que cette situation avait conduit certains de ses membres à s'en émouvoir.
M. Adrien Gouteyron, rapporteur spécial , a en outre estimé que les moyens de l'AFSSAPS méritaient souvent d'être mieux employés. L'Agence s'était ainsi constituée un très confortable « matelas » de trésorerie, le montant de son fonds de roulement s'étant établi à plus de 48 millions d'euros en 2001, soit une progression d'environ 28 % en trois ans. Ce niveau représentait 5,5 fois le montant du seuil incompressible du fonds de roulement en 1999, 6,3 fois son montant en 2000, 5,1 fois en 2001 et 6,4 fois en 2002. Il était destiné à financer les projets immobiliers de l'AFSSAPS, dont les ambitions avaient dû être revues à la baisse en raison des problèmes techniques et juridiques qu'elle avait rencontrés. Du reste, la Cour des comptes avait estimé que, si le nouvel immeuble projeté avait été effectivement construit, l'Agence aurait disposé de surfaces trop importantes. Ces réserves financières avaient donc connu une autre utilisation, essentiellement des prélèvements sur trésorerie destinés à rendre moins douloureuses les mesures de régulation budgétaire. Il s'est néanmoins déclaré persuadé que l'aisance financière de l'établissement constituait paradoxalement l'une des causes de sa négligence pour entreprendre les réformes destinées à la doter d'une gestion réellement performante.
Il a noté que les effectifs de l'AFSSAPS avaient, eux aussi, beaucoup augmenté. Fin 2002, elle disposait de 931 postes budgétaires, soit 204 agents de plus qu'en 1999, en hausse de 28 % en quatre ans. Les contractuels représentaient plus de 79 % des effectifs de l'Agence en 2002 et avaient vu leur part augmenter depuis 1999. Néanmoins, les vacances de postes pouvaient être relativement importantes, s'établissant aux alentours de 7 % chaque année, ce qui représentait entre 50 à 60 postes inoccupés. Surtout, l'AFSSAPS éprouvait de réelles difficultés de recrutement illustrées par des taux de rotation des personnels relativement importants, bien qu'en nette décroissance. Mais, depuis quelques années, l'effort de recrutement de l'Agence se concentrait davantage sur le remplacement d'agents démissionnaires plutôt que sur l'intégration de nouveaux profils liés aux créations de postes, d'autant plus qu'une augmentation des démissions avait pu être notée. Par ailleurs, il a souligné que les critères d'attribution de subventions par l'AFSSAPS n'étaient pas toujours bien établis, alors que les sommes en jeu n'étaient pas négligeables, représentant 4,32 millions d'euros en 2003. La Cour des comptes avait notamment mis en cause les conditions peu transparentes de l'attribution de subventions. Les débats au conseil d'administration confirmaient ce jugement, le contrôleur financier de l'établissement ayant notamment relevé « un manque de lisibilité financière et budgétaire ».
M. Adrien Gouteyron, rapporteur spécial , a mis en évidence le fait que, si les moyens de l'AFSSAPS avaient augmenté de façon continue et très sensible depuis 1999, ceux de la direction générale de la santé, qui exerçait auparavant une partie des actuelles missions de l'Agence, n'avaient pas, au contraire, diminué. Sur quatre exercices, de 1999 à 2002, les effectifs de la DGS avaient ainsi progressé de plus de 32 %. Les moyens de l'AFSSAPS et ceux de la DGS avaient donc augmenté parallèlement, bien que la seconde ait abandonné un nombre croissant de ses missions au bénéfice de la première. Il était cependant indéniable que l'AFSSAPS avait vu le développement de certaines de ses activités handicapé par les carences des services de l'Etat. C'était le cas, en particulier, du retard important pris en matière de publication des textes d'application de la loi du 1 er juillet 1998, ce retard ayant entravé la mise en place des missions nouvelles de l'Agence. Ainsi, au 12 février 2003, 50 textes étaient encore en attente de publication, dont 16 décrets en Conseil d'Etat, 7 décrets simples, 14 arrêtés et 13 arrêtés sur proposition du directeur général de l'Agence.
Il a par ailleurs estimé qu'il existait d'indéniables recoupements de compétences entre l'AFSSAPS et d'autres agences de sécurité sanitaire. Cette situation avait conduit à la création d'une instance de coordination, le comité national de la sécurité sanitaire, dont la Cour des comptes avait, du reste, critiqué la lourdeur du fonctionnement. Les agences avaient même dû mettre en place, entre elles, des procédures et mécanismes de coordination, qui formaient un ensemble relativement complexe. Il a considéré que l'Office parlementaire d'évaluation des choix scientifiques et technologiques devrait, au cours de sa mission d'évaluation, formuler des propositions afin de rationaliser le dispositif français de sécurité sanitaire.
Enfin, il a fait observer que l'Agence avait accordé une trop grande importance à ses missions traditionnelles, celles qui relevaient de l'ancienne Agence du médicament. Elle avait ainsi confié plus de moyens aux AMM qu'à la commission de la transparence, et cette situation emportait des conséquences non négligeables. Ainsi, les moyens limités de la commission de la transparence étaient, en partie, à l'origine du récent arrêt du Conseil d'Etat « Société Servier Monde » du 20 juin 2003, annulant un arrêté du 14 septembre 2001 qui avait diminué le taux de remboursement de certains médicaments, le faisant passer de 65 % à 35 %. Le Conseil d'Etat avait notamment mis en évidence l'insuffisante motivation des avis de la commission de la transparence. Cet arrêt avait été rendu alors que des recours de même nature étaient en cours d'examen et que le gouvernement préparait d'autres mesures de déremboursement, indispensables compte tenu de l'insuffisance du service médical rendu par certains médicaments mais aussi du coût qu'ils faisaient néanmoins peser sur les dépenses d'assurance maladie. Ainsi les moyens mal calibrés de la commission de la transparence avaient-ils, en partie, des répercussions directes sur la politique de maîtrise des dépenses de santé.
M. Adrien Gouteyron, rapporteur spécial , a ajouté que, en dépit des indéniables problèmes constatés dans la gestion de l'AFSSAPS, celle-ci avait néanmoins engagé des efforts, ou pris l'engagement d'en apporter, afin d'améliorer son fonctionnement. Il a ainsi mentionné les aspects sur lesquels il avait pu constater des premiers éléments de réformes :
- en matière de préparation du contrat d'objectifs et de moyens et de mise en place d'indicateurs, un auditeur de gestion avait été recruté avec la mission d'établir un premier référentiel d'indicateurs, qui devaient être discutés avec la tutelle à l'automne 2003 ;
- en matière de gestion des ressources humaines, un nouveau décret statutaire avait été publié le 7 mars 2003 : il fixait les règles applicables aux personnels contractuels de droit public recrutés par certains établissements publics intervenant dans le domaine de la santé publique ou de la sécurité sanitaire ; il permettait une approche par métiers et compétences et mettait à la disposition de l'Agence des outils de gestion des ressources humaines. En outre, un réajustement des effectifs trop nombreux de certaines équipes, notamment en thérapie génique, avait été effectué ;
- en matière d'expertise externe, la gestion des experts externes serait complètement transférée de la cellule de veille déontologique au département des ressources humaines, à l'automne 2003 ; par ailleurs, le dispositif de rémunération des experts devrait être actualisé pour permettre d'indemniser l'ensemble des commissions de l'AFSSAPS ;
- en matière d'information et de communication, la Cour des comptes avait considéré que, d'une manière générale, l'information demeurait le point faible de l'AFSSAPS. Or, celle-ci avait récemment engagé trois chantiers pour en améliorer l'efficacité et la portée : son système informatique avait été entièrement revu ; sa politique de communication avait été modernisée et son site Internet, notamment, était désormais beaucoup plus complet et donc crédible ; enfin, le projet « @MM » visait à accroître la transparence en matière de publication et de diffusion des décisions d'AMM, désormais mises en ligne.
Il a toutefois estimé que l'évaluation des activités de l'AFSSAPS demeurait, au plan qualitatif, encore insuffisante, l'Agence mesurant davantage ses activités que son efficacité. Les indicateurs qu'elle avait mis au point étaient très nombreux mais uniquement d'ordre quantitatif : ils permettaient de fournir « beaucoup de chiffres » mais peu d'analyses en termes de performances. Au total, il a considéré que l'AFSSAPS était une agence qui devait consolider les moyens relativement importants dont elle disposait, encore parfois fragiles aujourd'hui, mais qui jouait un rôle fondamental dans le dispositif français de sécurité sanitaire. La nouvelle évaluation de la loi du 1 er juillet 1998 devrait donc prendre en compte les améliorations apportées par l'Agence à son mode de fonctionnement.
M. Jean Arthuis, président , a félicité le rapporteur spécial pour la qualité de sa communication, rappelant que le contrôle était la « seconde nature » de la commission des finances. Il a observé qu'il n'était pas suffisant d'allouer des crédits budgétaires à un établissement public pour qu'il les utilise de façon optimale. Il a également déploré l'existence de recoupements de compétences entre les agences de sécurité sanitaire et formé le voeu que ce dispositif soit simplifié.
M. Eric Doligé a souhaité connaître les suites concrètes qui pouvaient être données à un tel contrôle.
M. Adrien Gouteyron, rapporteur spécial , a rappelé que son contrôle avait porté sur la seule AFSSAPS, alors que la mission d'évaluation dont était saisi l'Office parlementaire d'évaluation des choix scientifiques et technologiques avait un champ plus large, portant sur l'ensemble des agences de sécurité sanitaire. Cette étude transversale lui permettrait de formuler des propositions concrètes afin de mettre un terme aux actuels recoupements de compétences entre les agences. Il a néanmoins ajouté que la simple réalisation de contrôles incitait les organismes contrôlés à améliorer leur gestion. Tel était d'ailleurs le cas de l'AFSSAPS, contrôlée par la Cour des comptes, l'IGF et l'IGAS et le Parlement.
Puis la commission a donné acte au rapporteur spécial des conclusions de sa communication et décidé d'en autoriser la publication sous la forme d'un rapport d'information .
ANNEXES
Annexe n° 1 : Personnes auditionnées ou rencontrées lors de déplacements par votre rapporteur
Annexe n° 2 : Réponse de l'AFSSAPS à une question de votre rapporteur relative à sa politique immobilière
Annexe n° 3 : Formulaire de la déclaration publique d'intérêts
ANNEXE
N° 1 :
PERSONNES
AUDITIONNÉES OU RENCONTRÉES LORS DE DÉPLACEMENTS
PAR VOTRE RAPPORTEUR
Mme Florence Fuchs , directeur scientifique du site de l'AFSSAPS à Lyon
M. Lucien Abenhaïm , directeur général de la santé au ministère de la santé, de la famille et des personnes handicapées
M. Pierre-Antoine Bonnet , directeur scientifique du site de l'AFSSAPS à Montpellier
M. Christian Babusiaux , conseiller maître à la Cour des comptes, Mme Marianne Lévy-Rosenwald , conseiller maître, M. Jean-Christophe Potton , conseiller référendaire, et Mme Christine de Mazières , conseiller référendaire
Mme Sophie Thibault , inspecteur des finances, M. Pierre Aballea , inspecteur des affaires sociales, et Mme Carine Chevrier-Fatôme , inspecteur des affaires sociales
M. Philippe Duneton , directeur général de l'AFSSAPS, Mme Emmanuelle Wargon , adjointe au directeur général, Mme Marie-Hélène Tissier , directrice des laboratoires et des contrôles, et M. Jean-Hugues Trouvin , directeur de l'évaluation des médicaments et des produits biologiques
ANNEXE
N° 2 :
RÉPONSE DE L'AFSSAPS À UNE
QUESTION DE VOTRE RAPPORTEUR RELATIVE À SA POLITIQUE
IMMOBILIÈRE
1 - Depuis sa création, l'Agence a été obligée de prendre en compte, pour sa politique immobilière, la progression importante de ses effectifs (passés d'une centaine de personnes en 1993 à environ un millier de personnes à ce jour), accompagnant l'accroissement de ses champs de compétences conféré par les législateurs.
Pour répondre à ce défi, l'établissement a été amené à passer d'une gestion de 9.500 m² à l'origine à 36.000 m² aujourd'hui, ceci dans un contexte immobilier très fluctuant.
À cet effet, l'établissement a tenu régulièrement informé son conseil d'administration et, au travers de ce dernier, ses tutelles, ainsi que les organismes tels que le comité de décentralisation et les Domaines.
Ces derniers ont toujours répondu favorablement à ses sollicitations.
Aujourd'hui, les missions et les effectifs qui en découlent s'orientent vers une stabilisation. L'Agence s'est par ailleurs rendue acquéreur de bon nombre de ses locaux occupés et il nous est donc permis d'envisager la valorisation de son patrimoine immobilier.
Pour ce faire, une unité des affaires immobilières a été créée, qui aura en charge une gestion et une exploitation du parc immobilier (voir ci-après).
Il est à noter qu'à la demande de la tutelle, l'opération immeuble pointe nord Pleyel est suspendue, dans l'attente de la réalisation d'opérations immobilières en cours (regroupement des personnels du site de Saint-Denis au carrefour Pleyel sur le bâtiment étoile qui sera effectué en septembre 2003).
L'analyse des surfaces actuellement occupées par les différentes directions a également été réalisée (cf. ci-après) sur ces différents éléments et en tenant compte des possibilités éventuelles de financement. L'intérêt de l'opération immeuble pointe nord Pleyel sera réexaminé.
2 - Définition des besoins immobiliers de l'AFSSAPS
Il est exact que le détail des surfaces réellement occupées par les personnels était connu avec une précision insuffisante par l'Agence. Pour y remédier, l'AFSSAPS a commandé un audit de l'ensemble de ses surfaces immobilières. Le prestataire retenu a eu pour mission principale de dresser un tableau des ressources immobilières existant sur le site de Saint-Denis par zones géographiques et par directions. La volonté de la direction générale a été de connaître les surfaces des bureaux exploités et de faire ressortir le ratio m²/agent. Ce dernier représentera la justification des différentes prises à bail et servira de base à la politique et stratégie immobilière future.
Cette étude a été menée avec différents axes de réflexion.
Dans un premier temps, a été recensé pour chaque bureau :
- sa situation géographique,
- sa superficie,
- le nom des occupants, leur fonction, la direction, le département et l'unité de rattachement,
- le nombre de postes de travail utilisés,
- le nombre de postes de travail éventuellement disponible.
Cette étude a été réalisée en mars 2003 par le prestataire [...].
Dans un second temps, l'analyse a porté sur la différence entre la surface prise à bail dans son entier (couloirs, sanitaires, circulations, ascenseurs, parties communes, épaisseur des murs, pallier, monte charges, piliers, etc.) et celle utilisée pour les bureaux stricto sensu .
La seconde partie de la mission d'audit s'est donc attachée à mesurer les surfaces des immeubles de l'Agence en comparant les surfaces contractées dans les baux ou actes de vente et les surfaces réellement utilisées pour les bureaux. Le prestataire a donc fait apparaître ces données :
- surfaces des baux,
- surface utile théorique (70 % du bail si l'on retire les circulations, couloirs etc.),
- surface utile cloisonnée (- 5 % de la surface précédente).
En conclusion, il est désormais possible de déterminer le ratio de m² par agent. Ce dernier document fait apparaître le ratio moyen de l'ensemble des surfaces de Saint Denis (soit 12 m²) pour 876 personnes en activité recensées par le prestataire.
Il en ressort que le ratio général moyen, en tenant compte de toutes les surfaces, est de 13,87 m² par agent.
Il est néanmoins important de tempérer ce résultat : en effet, le tableau prend en compte toutes les surfaces, donc à la fois celles de bureaux, celles d'activité, celles de réunions, celles des laboratoires, celles des services généraux... On peut donc constater que le ratio moyen m² de bureaux/agent se situerait entre 10 et 12 m².
Enfin, l'Agence compte en plus des agents statutaires, des postes occasionnels, de stagiaires, d'internes et d'experts que le prestataire n'a pas pu prendre en compte lors de son passage. Ainsi, il faut donc savoir que le nombre annoncé de personnes travaillant à l'Agence est forcément supérieur. Ce point joue également sur le fait que le ratio m²/agent se trouve alors diminué.
Cette analyse est donc encore trop générale et devra être affinée en différenciant le type de surface et en séparant les agents permanents des occasionnels. Néanmoins elle conduit à des conclusions différentes de celles de la mission d'inspection, qui ne s'est fondée que sur la surface hors oeuvre nette (SHON) qui n'est pas le reflet de la proportion de surfaces occupée par les bureaux.
3 - Outils d'aide à la gestion immobilière
La gestion des opérations immobilières sera désormais fondée sur cette analyse des surfaces, ainsi affinée, complétée par l'utilisation d'un logiciel de gestion patrimoniale qui devrait être en application avant la fin de l'année 2003.
Ainsi, une étude de marché sur cet outil informatique est actuellement en cours afin de trouver le logiciel le plus adapté à ses spécificités et exigences. L'AFSSAPS doit en effet pouvoir disposer, d'une part, d'une gestion patrimoniale fondée sur une base de données de l'ensemble des informations collectées par cet audit, et, de l'autre, d'un outil permettant d'intégrer ces informations et de travailler sur l'ensemble des plans disponibles.
Le logiciel de gestion patrimoniale devra ainsi inclure :
- analyse des données relatives aux immeubles (superficies, situation géographique, positionnement des directions, nombres de postes de travail...),
- gestion administrative (bailleur, loyers, assurances, charges, coûts, taxes et impôts...),
- le traitement des données relatives à la gestion technique (travaux, maintenance, sécurité...),
- la base de données avec des plans et possibilité de travail en direct sur les plans avec Autocad.
Il est indéniable que cet outil servira à un meilleur suivi du parc immobilier et à une appréciation plus ciblée et précise des besoins.
La gestion patrimoniale sera ainsi plus efficace et réactive en cas de sollicitation de la part des directions opérationnelles ou des contacts extérieurs.
L'unité des affaires immobilières sera alors à même de déterminer les coûts d'exploitation et de maintenance pour anticiper au mieux des actions curatives et préventives. Une programmation pluriannuelle des dépenses immobilières pourra être établie et appliquée.
Cet outil de gestion valorisera l'ensemble des actions menées sur les immeubles et assurera une transparence dans la prise de décision. Les choix seront ainsi motivés et justifiés.
4 - Projet IPN
Concernant la construction d'IPN, il est utile de rappeler à la mission qu'il n'est pas pertinent de mettre au compte d'une insuffisance juridique de l'Agence l' « échec » de IPN. Ce marché avait en effet été délégué à un cabinet d'assistance à maîtrise d'ouvrage qui détenait la responsabilité pleine et entière de ce dossier.
La décision de fond de relancer ou non le projet reste en suspens. [...]
5 - La nouvelle unité des affaires immobilières
La gestion des opérations immobilières de l'AFSSAPS a été confiée à l'unité des affaires immobilières, créée en juillet 2002 au sein de la direction de l'administration et des finances.
Ses missions sont les suivantes :
Elaboration et mise en place de la stratégie immobilière et patrimoniale
Elaborer les plans de patrimoine et décider des actions à mener en fonction de la stratégie de l'Agence.
Valorisation du patrimoine
Procéder aux arbitrages et aux cessions d'immeubles ou de locaux.
Mettre en place une démarche de valorisation : construction d'immeubles, cession, location, etc.
Contrôle et maîtrise des coûts immobiliers
Contrôler le coût total immobilier et prendre les dispositions pour veiller en permanence à un rapport qualité/prix optimal.
Mettre en place et suivre des tableaux de bord et des indicateurs.
Construction
Rechercher et mettre en place les financements et assurer la maîtrise d'ouvrage des opérations, soit directement, soit indirectement.
Prises à bail
Coordonner les activités de gestion des prises à bail, qui comprend la recherche des nouveaux locaux et la gestion des baux en cours : paiement des loyers et des charges.
Gestion administrative et fiscale
Coordonner les activités de gestion administrative (inventaire immobilier) et fiscales de locaux : impôt foncier, taxe professionnelle, taxe sur les bureaux en Ile-de-France, etc.
Hygiène, sécurité et sûreté
Etablir, dans le respect des textes en vigueur, les dispositions à prendre en matière d'hygiène, de sécurité et de sûreté et contrôler leur application.
Gestion et exploitation des immeubles
Organiser et contrôler la gestion et l'exploitation des immeubles, en définissant les solutions optimales : moyens internes, entreprises sous contrats, contrats multitechniques ou multiservices, contrat de facilities management , etc.
Passation de nouveaux marchés et conventions.
Suivi des cloisonnements, des implantations...
Suivi des marchés et contrats « para-immobiliers » (téléphonie, assurance, restauration, archivage, câblage, mises aux normes, sécurité...).
Rapports avec les différents acteurs (syndic, propriétaires, copropriétaires, etc.).
Cette unité, qui regroupera six personnes aux compétences complémentaires, centralise donc les informations administratives, juridiques et financières, fédère ces données dans une démarche de valorisation des immeubles et répartit les travaux en fonction de leur nécessité sur les équipes des services généraux, du délégué à la sécurité ou sur les prestataires extérieurs.
* 1 L'étude de faisabilité de ces travaux a été présentée le 29 janvier 2003.
* 2 Décret n° 85-89 du 21 janvier 1985 portant statut particulier des personnels scientifiques du laboratoire national de la santé.
* 3 La loi du 1 er juillet 1998 a notamment été modifiée par la loi n° 2001-398 du 9 mai 2001 créant une Agence française de sécurité sanitaire environnementale et par la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé.
* 4 L'ancien président du conseil d'administration de l'AFSSAPS, le professeur Jean-Paul Cano, est décédé en cours de mandat, le 31 décembre 2002. Son successeur, M. Laurent Degos, a été nommé par décret en date du 14 mai 2003.
* 5 Votre rapporteur ne peut néanmoins que se féliciter de ce que le directeur général de l'Agence, qui dispose d'un pouvoir de proposition, même informel, pour la nomination des membres des conseils, ait explicitement « déconseillé » à la tutelle certaines personnes, en raison de leur trop grand nombre d'absences.
* 6 Il s'agit de la commission d'autorisation de mise sur le marché.
* 7 Comité économique des produits de santé.
* 8 Le formulaire de trois pages de la déclaration publique d'intérêts est annexé au présent rapport d'information.
* 9 Sur ce point, cf. le III.
* 10 Sur le retard de publication de ces textes, cf. le II.
* 11 Sur ce point, cf. le III.
* 12 Sur ce point, cf. le III.
* 13 Il convient cependant de noter que le retard pris dans l'audit de l'IGF et de l'IGAS est en partie imputable à l'AFSSAPS, qui, dans le cadre de la procédure contradictoire, a répondu avec retard aux observations des deux inspections générales.
* 14 Compte tenu de l'importance de cette question, on en trouvera la réponse complète annexée au présent rapport d'information.
* 15 Sur ce point, l'Agence a indiqué que « l'avis défavorable de la CSM rendu le 1 er août 2001 actait et déplorait que l'établissement n'avait pas été conseillé efficacement par son mandataire sur le déroulement des procédures à adopter alors que celles-ci faisaient partie intégrante de la mission qui avait été confiée à la société d'économie mixte Plaine développement, mission d'assistance à maîtrise d'ouvrage ».
* 16 C'est votre rapporteur qui souligne.
* 17 Le ministre de la santé, de la famille et des personnes handicapées, au cours de son audition devant votre commission des finances, le 4 juin 2003, a d'ailleurs confirmé l'actualité de cette pratique.
* 18 Par convention contre remboursement, les agents mis à disposition à l'AFSSAPS occupent des postes d'agents contractuels et sont comptabilisés à ce titre dans les effectifs permanents.
* 19 Les personnels contractuels se trouvent essentiellement à la direction des médicaments et produits biologiques.
* 20 Les personnels fonctionnaires travaillent, dans leur immense majorité, au sein de la direction des laboratoires et des contrôles.
* 21 Sur ce point, cf. le III.
* 22 A titre d'exemple, l'AFSSAPS verse des subventions à l'association française de normalisation (AFNOR), à l'union technique de l'électricité (UTE), à l'association de recherche, de communication et d'action pour le traitement du SIDA (ARCAT-SIDA) ou encore au groupe d'études thérapeutiques des affections inflammatoires digestives (GETAID) et à l'amicale des pharmaciens et des biologistes de Bégin.
* 23 Il s'agit de deux vasodilatateurs.
* 24 Cf. le rapport d'information de nos collègues Joseph Ostermann et Gérard Braun, « Mieux employer les personnels du ministère de l'emploi » (n° 65 ; 2000-2001).
* 25 En outre, certains projets de directives préparés par la France ont été rejetés par la Commission européenne qui les jugeait trop contraignants au regard de la législation communautaire ! En effet, la mise sur le marché des produits sanitaires autres que les médicaments est aujourd'hui essentiellement inspirée par l'esprit de l'Acte unique, c'est-à-dire par une logique de libre concurrence et de liberté de circulation, beaucoup plus que par une logique de qualité sanitaire. Dès lors, le système repose sur la reconnaissance mutuelle, les différents Etats membres devant faire confiance aux dispositifs nationaux. Néanmoins, un tel système pose de réels problèmes à l'égard de certains pays et en posera davantage encore avec l'élargissement en cours. D'ailleurs, des pays tels le Canada ont estimé que le système européen était trop « laxiste », n'offrant pas suffisamment de garanties en matière de sécurité sanitaire.
* 26 Encéphalite spongiforme bovine, dite « maladie de la vache folle ».
* 27 Sur ce point, cf. le III.
* 28 Décret n° 85-89 du 21 janvier 1985 portant statut particulier des personnels scientifiques du laboratoire national de la santé.
* 29 Décret n° 98-365 du 19 mai 1998 portant dispositions applicables aux agents contractuels recrutés sous contrat à durée indéterminée de droit public.
* 30 Les Entreprises du Médicament, anciennement Syndicat national des industries pharmaceutiques.
* 31 Sur ce point, cf. le II.
* 32 Maîtrise d'informatique appliquée à la gestion des entreprises.