Rapport d'information n° 864 (2012-2013) de M. Yves DAUDIGNY , fait au nom de la mission d'évaluation et de contrôle de la sécurité sociale et de la commission des affaires sociales, déposé le 26 septembre 2013
Disponible au format PDF (409 Koctets)
-
AVANT-PROPOS
-
I. LES MÉDICAMENTS
GÉNÉRIQUES : DES MÉDICAMENTS COMME LES AUTRES
-
II. LA PÉNÉTRATION LIMITÉE DES
GÉNÉRIQUES EN FRANCE S'EXPLIQUE PAR DIFFÉRENTS
FACTEURS
-
III. QUELQUES PROPOSITIONS RELATIVES À LA
POLITIQUE FRANÇAISE DU MÉDICAMENT, NOTAMMENT
GÉNÉRIQUE
-
I. LES MÉDICAMENTS
GÉNÉRIQUES : DES MÉDICAMENTS COMME LES AUTRES
-
RÉFÉRENCES BIBLIOGRAPHIQUES
SOMMAIRES
-
COMPTES RENDUS DES TABLES RONDES
(mercredi 19 juin 2013)
-
« PRINCEPS/GÉNÉRIQUE : QUELLE
ÉQUIVALENCE ? » : Pr Alain ASTIER, membre de l'Académie
nationale de pharmacie ; MM. Dominique MARANINCHI, directeur
général et Philippe VELLA, directeur des médicaments
génériques, homéopathiques, à base de plantes et
des préparations de l'Agence nationale de sécurité du
médicament et des produits de santé (ANSM) ; Pr Jean-Paul
TILLEMENT et Pr Jean SASSARD, membres de l'Académie nationale de
médecine
-
« EVALUATION DE LA POLITIQUE
FRANÇAISE DU MÉDICAMENT GÉNÉRIQUE » : M.
Claude BOUGE, directeur général adjoint du Leem - les entreprises
du médicament ; M. Pascal BRIÈRE, président du Gemme
(générique, même médicament) - Association des
professionnels du médicament générique ; M. Dominique
GIORGI, président du Comité économique des produits
de santé (Ceps) ; M. Sylvain PICARD, inspecteur général
des affaires sociales, co-auteur du rapport de l'Inspection
générale des affaires sociales sur l'évaluation de la
politique française des médicaments génériques
; Mme Mathilde LIGNOT-LELOUP, directrice déléguée
à la gestion et à l'organisation des soins de la Caisse nationale
d'assurance maladie (Cnam)
-
« PRINCEPS/GÉNÉRIQUE : QUELLE
ÉQUIVALENCE ? » : Pr Alain ASTIER, membre de l'Académie
nationale de pharmacie ; MM. Dominique MARANINCHI, directeur
général et Philippe VELLA, directeur des médicaments
génériques, homéopathiques, à base de plantes et
des préparations de l'Agence nationale de sécurité du
médicament et des produits de santé (ANSM) ; Pr Jean-Paul
TILLEMENT et Pr Jean SASSARD, membres de l'Académie nationale de
médecine
N° 864
SÉNAT
SESSION EXTRAORDINAIRE DE 2012-2013
|
Enregistré à la Présidence du Sénat le 26 septembre 2013 |
RAPPORT D'INFORMATION
FAIT
au nom de la mission d'évaluation et de contrôle de la sécurité sociale (1) et de la commission des affaires sociales (2) sur les médicaments génériques ,
Par M. Yves DAUDIGNY,
Sénateur.
|
(1) Cette mission est composée de : M. Yves Daudigny , président ; MM. Jacky Le Menn, Alain Milon , vice-présidents ; MM. Gilbert Barbier, Jean-Marie Vanlerenberghe , secrétaires ; Mme Jacqueline Alquier, M. Jean-Noël Cardoux, Mmes Annie David, Christiane Demontès, Catherine Deroche, MM. Jean Desessard, Jean-Pierre Godefroy, Ronan Kerdraon, Mme Isabelle Pasquet, M. René-Paul Savary. (2) Cette commission est composée de : Mme Annie David , présidente ; M. Yves Daudigny , rapporteur général ; M. Jacky Le Menn, Mme Catherine Génisson, MM. Jean-Pierre Godefroy, Claude Jeannerot, Alain Milon, Mme Isabelle Debré, MM. Jean-Marie Vanlerenberghe, Gilbert Barbier, Mme Catherine Deroche , vice-présidents ; Mmes Claire-Lise Campion, Aline Archimbaud, MM. Marc Laménie, Jean-Noël Cardoux, Mme Chantal Jouanno , secrétaires ; Mme Jacqueline Alquier, M. Jean-Paul Amoudry, Mmes Françoise Boog, Natacha Bouchart, Marie-Thérèse Bruguière, Caroline Cayeux, M. Bernard Cazeau, Mmes Karine Claireaux, Laurence Cohen, Christiane Demontès, MM. Gérard Dériot, Jean Desessard, Mme Muguette Dini, M. Claude Domeizel, Mme Anne Emery-Dumas, MM. Guy Fischer, Michel Fontaine, Bruno Gilles, Mmes Colette Giudicelli, Christiane Hummel, M. Jean-François Husson, Mme Christiane Kammermann, MM. Ronan Kerdraon, Georges Labazée, Jean-Claude Leroy, Gérard Longuet, Hervé Marseille, Mmes Michelle Meunier, Isabelle Pasquet, MM. Louis Pinton, Hervé Poher, Mmes Gisèle Printz, Catherine Procaccia, MM. Henri de Raincourt, Gérard Roche, René-Paul Savary, Mme Patricia Schillinger, MM. René Teulade, François Vendasi, Michel Vergoz, Dominique Watrin . |
AVANT-PROPOS
Mesdames, Messieurs,
Lors de l'élaboration de son programme de travail pour 2012-2013 et dans le prolongement des analyses faites chaque année, à l'occasion des lois de financement, par votre rapporteur général sur le marché des médicaments, la mission d'évaluation et de contrôle de la sécurité sociale (Mecss) du Sénat a souhaité aborder la question particulière des médicaments génériques, qui suscitent régulièrement des interrogations dans la presse et dans l'opinion publique.
Afin de permettre tout à la fois une présentation de différents points de vue et un débat contradictoire, la Mecss a organisé, le 19 juin 2013, deux tables rondes consécutives :
- la première privilégiait l'approche scientifique. Elle portait sur le thème « Princeps / Génériques : quelle équivalence ? » et rassemblait des représentants de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), de l'Académie de médecine et de l'Académie de pharmacie ;
- la seconde, plutôt axée sur une problématique économique et sociologique, portait sur le thème « Evaluation de la politique française du médicament générique ». Elle regroupait des représentants des laboratoires pharmaceutiques, du Comité économique des produits de santé (Ceps), de l'assurance maladie (Cnam) et de l'inspection générale des affaires sociales (Igas).
Le présent rapport rend compte de ces deux tables rondes et présente, de manière synthétique, la problématique du médicament générique.
I. LES MÉDICAMENTS GÉNÉRIQUES : DES MÉDICAMENTS COMME LES AUTRES
1. Une équivalence prouvée et des procédures d'inspection et de contrôle identiques à celles des autres médicaments
Le médicament générique connaît aujourd'hui un encadrement juridique très précis , tant au niveau communautaire que national. Selon l'article L. 5121-1 du code de la santé publique, un médicament générique « a la même composition qualitative et quantitative en principes actifs [que le médicament de référence] ainsi que la même forme pharmaceutique et [sa] bioéquivalence avec la spécialité de référence est démontrée par des études de biodisponibilité appropriées ».
Il s'agit donc de la copie d'un médicament original, qui peut présenter des différences avec lui tant qu'elles n'affectent pas la bioéquivalence , c'est-à-dire l'efficacité thérapeutique : ces différences ne doivent pas modifier la quantité et la vitesse auxquelles le principe actif est libéré dans l'organisme.
Phénomène relativement récent, la « générication » est la conséquence de la tombée dans le domaine public des brevets des nombreux et importants médicaments qui ont été commercialisés à partir des années 1970-1980. En tenant compte de la protection du brevet d'une durée de vingt ans à partir de son dépôt (soit souvent dix ans avant la commercialisation effective du produit en raison des délais d'études et d'autorisation) et de l'éventuelle protection complémentaire de cinq ans que peuvent demander les titulaires du brevet, un médicament est protégé, en pratique, entre une dizaine et une quinzaine d'années .
Le dispositif français du générique est basé sur la notion de « répertoire » des groupes génériques : lorsqu'une spécialité de référence, souvent appelée princeps, peut être « génériquée », elle est inscrite par les autorités dans un « groupe générique », qui regroupe la spécialité de référence et les spécialités qui en sont génériques. Au sein de ce groupe, l'ensemble des médicaments sont jugés équivalents et peuvent donc être substitués entre eux. Dans plusieurs pays européens, par exemple en Allemagne, les groupes de références sont plus larges alors que la définition française du groupe générique, donc du répertoire, est très étroite puisque limitée à une molécule, avec un dosage et une forme pharmaceutique.
Dans le respect du droit communautaire, un médicament générique ne peut être mis sur le marché qu'après une autorisation (AMM), qui fait suite à une évaluation identique à celle des princeps à l'exception des études pré-cliniques et cliniques qui ne sont pas exigées car elles sont, par définition, analogues à celles réalisées pour l'obtention de l'AMM du médicament princeps. Pour autant, une étude spécifique doit démontrer la « bioéquivalence », c'est-à-dire le fait que les quantités de principe actif circulant dans le sang sont comparables entre princeps et générique.
2. Certaines polémiques sur les génériques soulèvent en fait de vraies questions valables pour tous les médicaments
a) Les excipients à effets notoires
Outre sa substance active, un médicament est constitué d'autres produits, appelés excipients, qui permettent de lui donner certaines particularités « esthétiques » (goût, couleur, saveur...) mais surtout sa forme, sa stabilité ou sa capacité de dissolution. L'excipient participe donc pleinement de la capacité du médicament à agir.
Les excipients utilisés dans les médicaments génériques peuvent varier par rapport à ceux de leur princeps de référence mais ils doivent permettre une même « bioéquivalence ».
Si pour tel ou tel médicament, les excipients peuvent différer, il n'existe pas d'excipient spécifique pour les génériques ; l'industrie pharmaceutique utilise la même gamme d'excipients pour tous les médicaments.
Or, certains excipients, heureusement assez rares, peuvent produire des effets secondaires dits notoires, par exemple allergiques. Ces effets se produisent dans les mêmes proportions et conditions que le médicament soit un princeps ou un générique.
b) La qualité des matières premières
Les matières premières à usage pharmaceutique, qui entrent dans la composition des médicaments et doivent être conformes aux spécifications des dossiers d'AMM, sont les mêmes que le médicament soit un princeps ou un générique. Là non plus, il n'existe donc pas de situation particulière pour les génériques.
L'évolution économique entraîne, pour l'ensemble des médicaments , des difficultés qu'il sera nécessaire de prendre en compte attentivement. La production est de plus en plus mondialisée et fragmentée en étapes diverses, ce qui pose des problèmes de traçabilité, de capacités d'inspection et de ruptures de stocks potentielles. Selon le rapport de l'Igas cité en annexe, entre 60 % et 80 % des matières premières seraient fabriquées dans des pays hors Europe, principalement en Asie (Inde et Chine 1 ( * ) ), et les inspections de sites de production, peu nombreuses, mettent en évidence de graves dysfonctionnements.
II. LA PÉNÉTRATION LIMITÉE DES GÉNÉRIQUES EN FRANCE S'EXPLIQUE PAR DIFFÉRENTS FACTEURS
1. Etat des lieux des génériques en France : seulement 26 % du marché du médicament remboursable en volume et 14 % en valeur
En 2012, les génériques représentaient près de 14 % du marché des spécialités remboursables en valeur et plus de 26 % en quantités, soit un peu plus d'une boîte sur quatre. Ces taux ont crû continûment depuis l'introduction effective des génériques à la fin des années 1990. Cependant, on peut noter que la progression a été nettement plus importante en volume qu'en valeur, ce qui révèle - s'il en était besoin - l'intérêt économique du développement des génériques pour les finances publiques. A cet égard, la Cnam évalue à 8,5 milliards d'euros les économies réalisées entre 2002 et 2012 grâce aux génériques du seul fait de la substitution , montant auquel il faut ajouter environ 2 milliards d'euros de baisses de prix des princeps concernés par la commercialisation des génériques.
Evolution de la part des génériques
dans le marché des spécialités
remboursables
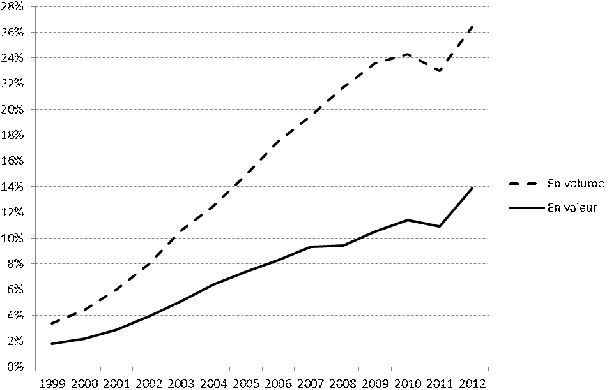
Source : Mecss, d'après données de l'ANSM
Le marché des génériques a particulièrement progressé en 2012 du fait de la réactivation de la mesure « Tiers-payant contre générique » par l'assurance maladie et les pharmaciens : généralisé, ce dispositif constitue une forte incitation financière pour les patients, même si son application ne constitue aucunement un déremboursement.
Aujourd'hui, le taux de pénétration des génériques est particulièrement élevé lorsqu'il est rapporté au seul répertoire (84 % à la fin de 2012). Pourtant, ces médicaments ne représentent que 26 % des volumes du marché total . Il existe donc encore de nombreux princeps qui ne sont pas « inscrits au répertoire », soit pour des raisons juridiques de propriété intellectuelle, soit pour des raisons d'opportunité ; ils ne peuvent donc pas être « génériqués ». En outre, les prescriptions « hors répertoire » sont également élevées ( cf. infra ).
Même si les comparaisons internationales doivent être regardées avec circonspection en raison des champs d'étude parfois différents, elles montrent toutes une marge de progression importante par rapport à la plupart des pays occidentaux. Ainsi, selon une étude citée par l'ANSM, la part de marché des génériques dans celui des médicaments non protégés par un brevet s'élève à 52 % en France contre 71 % au Royaume-Uni, 75 % en Allemagne, 81 % au Canada et 89 % aux Etats-Unis. Certes, les pays « latins » sont dans une situation inverse puisque ce taux de pénétration est proche de 40 % en Espagne et en Italie.
2. Les stratégies des laboratoires pour limiter le développement des génériques
Longtemps, les laboratoires pharmaceutiques qui exploitent des princeps ont logiquement développé des stratégies pour protéger leurs ventes. Ces procédés ont diminué - d'ailleurs, de nombreuses entreprises ont créé des filiales dédiées à la production de médicaments génériques - mais certaines perdurent.
Les laboratoires déposent par exemple une multitude de brevets secondaires peu avant l'expiration du brevet principal, ce qui rend plus complexe et moins sûr juridiquement le développement par un autre industriel du médicament générique correspondant. Des recours en justice, plus ou moins fondés sur des bases sérieuses, peuvent également retarder la mise sur le marché de génériques.
Par ailleurs, les laboratoires peuvent parfois conclure des accords qui, directement ou indirectement, aboutissent à limiter la concurrence ou le développement des génériques.
Surtout, une partie des ressources en recherche et développement de certains laboratoires a été utilisée pour créer des « mee-too » : ces produits, qui n'ont pas tout à fait le même principe actif que le produit initial mais le même profil thérapeutique et qui en sont globalement très proches, sont commercialisés peu de temps avant l'échéance du brevet précédent. Ainsi, ce soi-disant nouveau produit est efficace et rend, par construction, le même service médical que le princeps initial mais il est inutile pour les patients et la collectivité, en n'améliorant pas ce même service médical. Or, du fait des règles d'admission au remboursement et de fixation des prix des médicaments en France, les « mee-too » ont souvent permis d'empêcher en pratique le développement des génériques du premier princeps. Le comité économique des produits de santé (Ceps) prend en compte, depuis peu, cette particularité lors de la fixation du prix.
La stratégie des « mee-too », qualifiée à juste titre par l'Igas de « financement inutile par la collectivité de fausses innovations », n'a pu fonctionner qu'en raison de l'appétence des prescripteurs pour la nouveauté. Or, celle-ci est particulièrement stimulée par le procédé des « visites médicales », part essentielle de la stratégie des laboratoires. Les visiteurs médicaux ne promeuvent auprès des médecins que des médicaments princeps, la communication des laboratoires de génériques s'orientant principalement vers les pharmaciens.
Au-delà de la visite médicale « classique », les laboratoires ont également développé une stratégie plus subtile mais très efficace vis-à-vis des « leaders d'opinion » en santé.
3. La question de la prescription
a) Un cas d'école : les statines
Dans son dernier rapport « charges et produits » cité en annexe, la Cnam met en avant la question de la prescription des statines , médicaments destinés à traiter l'excès de cholestérol dans le sang, qui constituent l'une des plus importantes classes thérapeutiques en France avec 6,4 millions de patients et 1,2 milliard d'euros de remboursements annuels par l'assurance maladie. Cinq molécules sont commercialisées en France, dont quatre sont inscrites au répertoire et sont « génériquées » (atorvastatine 2 ( * ) , simvastatine, pravastatine et fluvastatine) et une ne l'est pas (rosuvastatine 3 ( * ) ).
Déjà en juillet 2010 4 ( * ) , la Haute autorité de santé estimait que, « en termes comparatifs, aucune différence significative n'a été démontrée entre les statines sur le critère de mortalité toutes causes . » En outre, « la hiérarchie des prix constatés n'est pas strictement proportionnelle à la progression de l'efficacité des différentes statines . » La HAS en conclut que, « compte tenu de l'efficacité biologique moyenne des différentes statines en termes de baisse attendue de LDL-c et des prix français de ces molécules en septembre 2010, la prescription d'une simvastatine générique est à envisager en priorité pour les hypercholestérolémies faibles à modérées, avec un dosage adapté à la valeur cible recherchée. » Elle estime que la délivrance de la rosuvastatine n'est à « envisager en priorité » que dans un nombre très limité de cas.
Entre 2010 et 2012, la Cnam a mené une vaste étude portant sur 165 000 patients : elle ne montre pas non plus de différence significative d'efficacité sur la morbimortalité entre la rosuvastatine 5 mg et la simvastatine 20 mg.
Or, la rosuvastatine, seule spécialité non « génériquée », totalise 30 % des volumes prescrits contre 4 % au Royaume-Uni ou 0,5 % en Allemagne ! Dans sept pays européens (Allemagne, Royaume-Uni, Pays-Bas, Italie, Finlande, Norvège et Espagne), cette molécule représente moins de 8 % des volumes.
De ce fait, le coût moyen journalier des traitements par statine est deux fois plus élevé en France qu'en moyenne dans ces pays , alors que l'équivalence thérapeutique des statines est largement démontrée et sans que l'on puisse avancer soit que la population française souffre d'une affection qui nécessite une thérapie particulière par rapport aux autres Européens, soit qu'elle est nettement mieux soignée ainsi...
b) Le choix français de la « substitution » : une fragilité, voire un péché originel
Les volumes de médicaments vendus en France ont moins progressé ces dernières années que dans les autres pays européens mais, partant d'un niveau élevé de consommation, la France se situe encore dans le haut de la moyenne européenne : selon les comptes nationaux de santé pour 2012, la consommation française mesurée en unités standards par habitant reste 22 % supérieure à celle observée dans les pays voisins.
Surtout, la structure des prescriptions reste orientée vers les molécules les plus onéreuses et est défavorable aux médicaments appartenant au répertoire des génériques. La Cnam a ainsi évalué que, pour un ensemble de huit classes thérapeutiques 5 ( * ) , la France connaît le coût moyen de traitement par habitant « de loin le plus élevé » parmi huit pays de comparaison 6 ( * ) .
Cette situation provient largement du choix de ne pas agir dès la prescription du médicament mais au moment de sa délivrance par le pharmacien. La loi de financement de la sécurité sociale pour 1999 a accordé à ce dernier le droit, sous certaines conditions, de substituer au produit explicitement prescrit par le médecin l'un de ses génériques. Un fort intéressement financier, à la fois au niveau de la marge et du prix d'achat, a été décidé pour que les pharmaciens opèrent bien cette substitution ; cette décision ne rend que plus dépendants encore les pharmaciens du volume de boîtes vendues, ce qui n'est guère satisfaisant.
La politique de « substitution » a bien permis le développement important du médicament générique, mais elle présente de redoutables inconvénients : sans accompagnement particulier, elle ne peut qu'instiller un doute dans l'esprit du patient, qui ne se voit pas délivrer le « bon médicament », tandis que le médecin, largement écarté de la procédure, n'est guère incité à modifier ses prescriptions. Certes, les conventions médicales successives ont mis en place quelques dispositifs incitatifs pour améliorer la qualité de la prescription mais les résultats sont très lents.
La plupart des autres pays ont adopté des politiques différentes, souvent plus directives vis-à-vis des médecins : par exemple, la prescription obligatoire en « dénomination commune internationale » (DCI), c'est-à-dire avec le nom de la molécule et non le nom commercial du produit, permet de lever largement les doutes du patient sur le produit finalement délivré.
Une politique basée sur la seule substitution ne peut qu'entamer la confiance des médecins et des patients dans le médicament générique ; elle explique largement les prises de position de certains leaders d'opinion, relayées par nombre de media, sur la qualité de ces médicaments, la France étant d'ailleurs le seul pays à connaître ces polémiques récurrentes.
c) La prescription hospitalière
Si le marché du médicament se concentre dans les pharmacies de ville (23 milliards d'euros de dépenses remboursées en 2011), les prescriptions par les médecins hospitaliers en constituent un déterminant essentiel. Ces derniers agissent en effet comme des « primo-prescripteurs » pour de nombreux traitements, dont les plus coûteux car concernant des pathologies lourdes ou des phases aiguës de la maladie, les médecins de ville procédant au renouvellement de la prescription. En outre, les médecins hospitaliers jouent plus généralement un rôle de « leader » d'opinion en santé.
Depuis plusieurs années, la croissance du marché est alimentée par les médicaments de spécialités destinés aux pathologies lourdes et graves (cancer, sida, hépatites, DMLA...), alors que les dépenses liées aux maladies chroniques ou saisonnières tendent à diminuer du fait du développement des génériques ou des baisses de prix décidées par les pouvoirs publics. La Cnam a ainsi estimé qu'en 2009, 70 % de la croissance des dépenses de médicaments délivrés en officine provient en fait des prescriptions hospitalières.
Or, alors que le prix des médicaments est « administré » pour la délivrance en pharmacie, les établissements de santé procèdent à des appels d'offres et les entreprises consentent souvent des prix très bas, voire fournissent des médicaments quasi-gratuitement . Dans les classes très concurrentielles comme les statines, les niveaux de remise sont très élevés : le prix médian d'une dose journalière est divisé par sept en CHU par rapport à celui en officine pour les inhibiteurs de l'enzyme de conversion (IEC).
Certains laboratoires ont d'ailleurs pu, là aussi, mettre en place des stratégies agressives visant à limiter le développement des génériques. La société GlaxoSmithKline a par exemple été sanctionnée en mars 2007 par le Conseil de la concurrence, mais cette décision a été réformée par la Cour d'appel de Paris, notamment au regard de la définition exacte du marché concerné, arrêt confirmé par la Cour de cassation 7 ( * ) . Dans son communiqué de presse, le Conseil de la concurrence utilisait des termes particulièrement sévères : « Le laboratoire Glaxo a vendu, en 1999 et 2000, un produit à un prix inférieur à ses coûts afin de dissuader les génériqueurs d'entrer efficacement sur le marché hospitalier. [...] Les prix proposés par Glaxo sur ce médicament [ont] eu un caractère prédateur . [...] Un prix prédateur est un prix anormalement bas, c'est-à-dire inférieur aux coûts variables de l'entreprise qui le pratique. Le mécanisme de prédation est le suivant : l'entreprise offre dans un premier temps des prix très bas dans le but d'évincer ou de décourager l'arrivée de la concurrence sur un marché donné. Une fois la concurrence éliminée, l'entreprise peut alors remonter ses prix et récupérer les pertes consenties pendant la première phase, au détriment du consommateur. »
Finalement, établissements de santé et laboratoires trouvent chacun un intérêt au fonctionnement actuel : les premiers bénéficient de prix bas, y compris pour certains médicaments innovants et théoriquement coûteux, ce qui est bénéfique pour les finances publiques ; les seconds influencent un marché plus large par un mécanisme qui peut s'apparenter à du « dumping » dans certaines situations, ce qui pénalise de ce point de vue les finances publiques.
Ainsi, la Drees a récemment montré une corrélation significative entre les référencements de médicaments dans un CHU et leur poids dans les prescriptions des médecins libéraux exerçant dans son bassin d'attraction : plus le CHU utilise un médicament donné, plus celui-ci est consommé dans cette zone.
III. QUELQUES PROPOSITIONS RELATIVES À LA POLITIQUE FRANÇAISE DU MÉDICAMENT, NOTAMMENT GÉNÉRIQUE
Depuis plus d'une dizaine d'années, le volume de médicaments consommés en France progresse chaque année mais de manière moins rapide exercice après exercice : + 9,7 % en 2000, + 6,5 % en 2006 et + 2,4 % en 2012.
Dans le même temps, l'outil principal de maîtrise de l'Ondam a consisté à baisser les prix des médicaments, qui étaient globalement à un niveau élevé par rapport à la plupart des pays européens ; de ce fait et en raison du développement des génériques, les prix ont globalement diminué d'un peu plus de 2 % par an .
Au total, le marché du médicament a connu jusqu'en 2011 une progression annuelle de moins en moins forte et, en 2012, il a baissé pour la première fois (- 0,9 %).
Partant d'une situation relativement atypique caractérisée par des niveaux élevés tant de volumes que de prix, le marché français du médicament tend aujourd'hui à se rapprocher de celui des pays européens comparables : les volumes progressent moins vite que dans ces pays et les prix diminuent. Pour autant, cette évolution n'apparaît pas nécessairement comme soutenable dans la durée car elle ne s'appuie pas sur des changements structurels de consommation et, surtout, de mentalités.
Votre rapporteur estime que les pouvoirs publics doivent mettre en oeuvre une politique globale du médicament qui agisse le plus en amont possible sur la demande de la part des patients et sur les habitudes de prescription par les médecins .
|
Propositions
|
Enfin, votre rapporteur avait souligné, lors des débats du projet de loi de financement de la sécurité sociale pour 2013, l'importance de préparer l'avenir et le passage des médicaments « chimiques » aux médicaments biologiques : la chimie a indéniablement constitué un moteur de développement et d'amélioration des conditions de vie, notamment en matière de santé dans le traitement curatif, mais le siècle nouveau devrait plutôt voir l'avènement des techniques liées à la biologie et à l'humain.
De manière plus immédiate, plusieurs brevets importants de médicaments biologiques vont arriver à échéance dans les prochaines années et les laboratoires pourront alors commercialiser des médicaments « biosimilaires », application du concept de générique à ce secteur. La logique de la substitution, qui présente déjà des défauts pour les médicaments classiques, est mal adaptée pour ce type de médicaments issus du vivant et doit être renouvelée. Ces évolutions doivent être anticipées pour éviter de subir les mêmes difficultés que celles rencontrées pour le développement des médicaments génériques.
*
* *
RÉFÉRENCES BIBLIOGRAPHIQUES SOMMAIRES
• Agence nationale de sécurité du médicament et des produits de santé (ANSM) : « Les médicaments génériques : des médicaments à part entière », décembre 2012.
• Agence nationale de sécurité du médicament et des produits de santé : « Analyse des ventes de médicaments en France en 2012 », juillet 2013.
• Inspection générale des affaires sociales (Igas) : « Evaluation de la politique française des médicaments génériques », Dorothée Imbaud, Alain Morin, Sylvain Picard et François Toujas, septembre 2012.
• Académie nationale de médecine : « Place des génériques dans la prescription », février 2012.
• Académie nationale de pharmacie : « Médicaments génériques », décembre 2012.
• Caisse nationale d'assurance maladie (Cnam) : « Améliorer la qualité du système de santé et maîtriser les dépenses : propositions de l'assurance maladie pour 2014 », rapport au Gouvernement et au Parlement, juillet 2013.
COMPTES RENDUS DES TABLES RONDES
(mercredi 19 juin
2013)
« PRINCEPS/GÉNÉRIQUE : QUELLE ÉQUIVALENCE ? » : Pr Alain ASTIER, membre de l'Académie nationale de pharmacie ; MM. Dominique MARANINCHI, directeur général et Philippe VELLA, directeur des médicaments génériques, homéopathiques, à base de plantes et des préparations de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) ; Pr Jean-Paul TILLEMENT et Pr Jean SASSARD, membres de l'Académie nationale de médecine
M. Yves Daudigny, président . - La Mecss a décidé, en décembre dernier, de s'intéresser à la question des médicaments génériques, qui suscite régulièrement des interrogations. C'est dans cet objectif que nous organisons, cet après-midi, deux tables rondes, la première portant sur « princeps/générique : quelle équivalence ? », la seconde sur l'évaluation de la politique française du médicament générique.
Pour cette première table ronde, nous recevons le professeur Dominique Maraninchi, directeur général de l'Agence nationale de sécurité du médicament et des produits de santé, qui est accompagné de M. Philippe Vella, directeur des médicaments génériques, homéopathiques, à base de plantes et des préparations à l'ANSM ; le professeur Alain Astier, membre de l'Académie de pharmacie et les professeurs Jean-Paul Tillement et Jean Sassard, membres de l'Académie nationale de médecine.
L'Académie de médecine a adopté, le 14 février 2012, un rapport sur la place des génériques dans la prescription, qui avait eu un écho médiatique certain. L'Académie de pharmacie a adopté, le 5 décembre 2012, un rapport sur les médicaments génériques proprement dits, après avoir publié divers autres documents scientifiques sur ce sujet.
Au-delà de l'actualité récente qui reste assez mystérieuse et qui aurait pu concerner tout type de médicament, nous savons bien qu'un certain nombre d'inquiétudes se manifestent régulièrement en France à l'égard des génériques, notamment en ce qui concerne l'équivalence de leur efficacité avec le médicament princeps. C'est sur ce thème que porte notre première table ronde.
M. Dominique Maraninchi, directeur général de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) . - J'ajoute à la liste des documents traitant du sujet qui nous occupe le rapport publié par l'ANSM fin 2012, qui présente la situation des génériques en France et dans le monde.
Si l'on en revient aux définitions, un générique est un médicament dont la qualité, la sécurité et le principe actif sont les mêmes que ceux du médicament princeps car la forme pharmacologique, la biodisponibilité et la bioéquivalence sont les mêmes. Un médicament se caractérise par son principe actif, son efficacité, par sa capacité de distribution dans le corps.
Du point de vue de la mise sur le marché, les médicaments génériques sont traités exactement comme les autres médicaments. Vous savez qu'entre 3 000 et 5 000 substances actives sont autorisées en France et 1 000 sont inscrites au répertoire des génériques pour environ 7 000 spécialités. Les génériques sont donc bien représentés parmi les médicaments disponibles.
Les médicaments génériques sont soumis comme les autres à une évaluation préalable à la commercialisation, l'autorisation de mise sur le marché (AMM), qui est dans 80 % des cas, nationale. Ce travail constitue une part importante de l'activité de l'agence. Par nature, il n'y a pas, dans un dossier d'AMM de générique, d'étude clinique démontrant la relation bénéfice risque pour une maladie spécifiée et dans une indication précise. Ce travail n'a pas à être refait puisque le principe actif et la distribution dans l'organisme sont les mêmes que ceux du médicament princeps. L'AMM se fait donc principalement sur la base d'un dossier pharmaceutique et d'une évaluation de la bioéquivalence. Certains médecins disent que les génériques ne sont pas testés. Mais à partir du moment où les critères de bioéquivalence sont réunis, l'effet thérapeutique est le même. A chaque fois, le même principe actif est utilisé dans les médicaments produits.
Une fois les génériques autorisés, ils entrent, depuis 2004, dans un répertoire, ce qui est une spécificité française. C'est cela qui permet à tous les acteurs de la prescription et de la distribution d'opérer des substitutions en toute transparence.
Les génériques par voie injectable, qui sont très peu nombreux, ne font pas l'objet d'une étude de bioéquivalence car on vérifie qu'il s'agit du même produit, à la même dose, dans une même ampoule. Une fois injecté dans l'organisme, le médicament produira le même effet que le princeps car c'est strictement le même produit. Certains le contestent, notamment dans le cas de la vancomycine colombienne ; une étude en Colombie montrerait qu'elle est moins efficace que la vancomycine d'origine. Nous avons contesté cette approche. Nos laboratoires de contrôle ont fait une étude in vivo chez l'animal, qui a établi l'équivalence entre les formes de vancomycine générique et le principe actif d'origine.
Il faut le maximum de transparence et d'information pour que la population soit bien consciente que le générique n'est pas un médicament au rabais. Ce n'est pas parce qu'ils sont moins chers qu'ils sont de moins bonne qualité. Or, il est légitime qu'ils soient moins chers puisque moins d'études cliniques sont conduites pour leur mise sur le marché. L'agence autorise, mais aussi interdit, des médicaments génériques en utilisant un système d'information mais aussi d'inspection et de contrôle. Nous avons diligenté de nombreux contrôles et testé certains génériques dans nos laboratoires. Nous déclenchons aussi des campagnes d'inspection. Certains se demandent si les génériques sont moins chers parce qu'ils sont moins bien produits ou qu'ils le sont dans des pays où les inspections sont moins contraignantes. Nos inspections sont coordonnées avec l'Agence européenne du médicament et la Food and Drug Administration des Etats-Unis. Elles trouvent parfois des anomalies graves ou mineures car elles sont ciblées sur les médicaments pour lesquels nous avons un doute. Les inspections de routine ne montrent pas de différence entre les conditions de production des génériques et des princeps. Nous avons une politique de surveillance identique pour les deux et bien souvent ce sont d'ailleurs les mêmes firmes qui les commercialisent en utilisant les mêmes chaînes et modes de production.
Comme tout médicament qui contient un principe actif, il y a des bénéfices et des risques et nous exerçons donc une vigilance. Nous n'avons repéré aucun indice particulier qui indiquerait que les incidents sont plus fréquents pour les génériques que pour les princeps. L'agence travaille globalement pour la sécurité des patients et surveille l'ensemble des classes de médicaments. Nous ne laisserons pas sur le marché un principe actif dangereux.
Reste une question, celle de l'efficacité de la politique du générique. Nos maîtres mots à l'ANSM sont transparence et réactivité. Ce n'est pas parce qu'un médicament est autorisé qu'il faut l'utiliser. L'abus du médicament a toujours des effets néfastes. Un médicament se situe dans des indications particulières. Dans certaines situations médicalement sensibles, notamment chez les personnes âgées ou dans les cas de personnes greffées ou souffrant d'une épilepsie chronique, une substitution forcée peut entraîner une perte de confiance. Des dispositions législatives existent désormais pour permettre que l'apparence du générique soit identique à celle du princeps. Mais pour les malades chroniques qui ont été péniblement équilibrés avec un médicament, la substitution peut être source de doute et nous sommes donc particulièrement attentifs à ces situations. Elles sont heureusement rares. La relation entre le malade, le prescripteur et le distributeur est aussi un gage de sécurité et d'acceptabilité.
Pr Alain Astier, membre de l'Académie nationale de pharmacie . - L'Académie nationale de pharmacie a adopté un rapport fin 2012 avec une approche purement scientifique. Nous avons ainsi conduit une étude systématique de la littérature scientifique accessible, fait une analyse bibliographique et une méta-analyse.
Nous avons cherché à savoir si la bioéquivalence, c'est-à-dire le fait qu'un médicament absorbé arrive à la même vitesse et avec la même quantité dans l'organisme, entraîne l'équivalence clinique. C'est sur ce point que porte une partie des contestations. Certains contestent la fiabilité des études de bioéquivalence et même si les produits sont bioéquivalents, on affirme qu'il y a des différences cliniques. Or, aucune étude dont on peut s'assurer de la pertinence ne montre de différence significative entre les génériques et les princeps. Très souvent, les laboratoires de princeps sont leur propre « génériqueur » et tiennent un double discours devant les pharmaciens hospitaliers. Il y a beaucoup d'intérêts et de lobbies qui agissent sur cette question, alors que la France utilise près de trois fois moins de génériques que les Etats-Unis et qu'en Allemagne, le taux de recours au générique est de 63 % ou 64 % alors que nous sommes à 25 % en France. Il y a là une spécificité française qui n'est pas fondée sur un « rationnel » scientifique. Une étude a d'ailleurs montré que le même médicament, quand il est prescrit avec empathie, de manière neutre ou avec réticence, produit respectivement 60 %, 40 % et 20 % d'efficacité ! L'attitude du médecin, dans certaines pathologies où le facteur psychologique est important dans la survenue de signes cliniques objectifs, produit donc un facteur trois d'efficacité. Il y a une part objective et une composante psychologique. L'effet placebo ou nocebo est connu. C'est un élément important.
La somme totale de l'efficacité d'un médicament est composée des éléments objectifs et des facteurs extrinsèques. Il faut donc faire attention à la manière dont est présenté le recours au générique. D'ailleurs, quand, dans le cadre d'une étude, on fait passer le princeps pour le générique, on note les mêmes variations en termes d'efficacité. Aujourd'hui donc, aucun élément ne permet de dire objectivement qu'un générique soit moins efficace qu'un princeps. Il faut cependant que le traitement soit le même. Le problème de l'observance est un problème majeur. Par exemple, la moitié des patients hypertendus ne prennent pas leurs traitements. La chronicité fait que le patient ne prend pas son médicament. Si l'on ajoute à cette non-adhésion spontanée de tout patient une pression relative à l'efficacité du médicament, il se passe quelque chose. Le manque de confiance plus ou moins entretenu à l'égard des génériques doit donc être combattu.
Pr Jean-Paul Tillement, membre de l'Académie nationale de médecine . - Le rapport de l'Académie de médecine a sans doute été le premier publié avec le retentissement que vous avez évoqué. L'Académie a pris acte sans ambiguïté de l'utilisation du générique, sachant qu'il s'agit d'une décision mondiale et généralisée. La seule question est que les génériques proposés doivent être parfaitement adaptés à la substitution et il faut que celle-ci se fasse sans aucune difficulté. L'Académie s'est auto-saisie suite à des demandes de praticiens qui ont signalé des différences d'efficacité et des problèmes d'identification. Le rapport a été confié à un praticien prescripteur de génériques dans des maladies chroniques. Avec quels médicaments a-t-on observé des plaintes ? Quelle est leur véracité ? La littérature internationale montre globalement une bonne bioéquivalence entre génériques et princeps.
La conclusion du rapport est sans ambiguïté, elle tient dans le titre même du rapport « La place des génériques dans la prescription ». Il faut un effort de pédagogie pour expliquer que les médicaments génériques, mêmes s'ils ne sont pas identiques aux princeps, sont équivalents et peuvent parfaitement être substitués. C'est notre première recommandation.
Je souhaite néanmoins faire état des difficultés rencontrées face aux différences de présentation entre générique et princeps. Les couleurs, le recours à une gélule moins coûteuse qu'un comprimé ou les présentations sous forme de comprimés multi-sécables, parfois quadri-sécables, peuvent faire perdre leurs repères aux patients ou rendre la prise du traitement plus difficile.
S'il n'y a pas de cas d'allergie avéré aux excipients utilisés par les génériques, je signale un article de presse indiquant qu'un collyre générique a semblé poser des problèmes de tolérance.
Il y a un problème d'acceptabilité de certains médicaments génériques. La bioéquivalence doit également être surveillée spécialement pour certaines classes pharmacologiques signalées dans la littérature internationale.
Nous pensons qu'il faut limiter au maximum les changements de médicaments chez un même malade. Surtout, il ne faut pas multiplier les changements de génériques chez un même patient car il perdra ses repères. On pourrait privilégier le fait de commencer les traitements avec le générique. La fidélité du malade au pharmacien et la mise en place du dossier pharmaceutique peuvent permettre un meilleur suivi.
La prescription en dénomination commune internationale (DCI) est également à développer pour limiter les risques de confusion liés au nom de spécialité.
Pr Jean Sassard, membre de l'Académie nationale de médecine . - Je souhaite insister sur la nécessité que la présentation du générique soit la même que celle du princeps. Par ailleurs, quand un patient est équilibré avec un médicament il ne faut pas le changer.
Je trouve également la définition de la bioéquivalence dans les textes particulièrement obscure et je pense qu'il faudrait lui trouver une alternative qui permettrait une argumentation plus facile.
Enfin, la délocalisation de la production des médicaments génériques impose, à mon sens, une accréditation des structures de contrôle permettant d'éviter les distorsions.
M. Dominique Maraninchi . - On voit bien la difficulté qui résulte de l'oscillation entre le vécu, le ressenti et les données objectives. Je souhaite souligner que ce problème n'est pas propre aux génériques qui ont soigné de très nombreuses personnes dans le monde, mais qu'il concerne tous les médicaments.
Le concept de bioéquivalence peut paraître obscur mais il s'agit d'un texte opposable aux firmes pharmaceutiques. Il est donc préférable qu'il soit compris par ceux à qui il s'impose plutôt que par le grand public.
Il faut également que nous évoluions dans nos pratiques au regard du médicament. Les reconnaître à la couleur est toujours dangereux. La présentation identique est possible, reste à savoir si les firmes le feront. Mais le principe actif sera de toute façon le même.
Il me semble qu'il ne faut pas forcer les situations médicales dramatiques et user de bon sens en matière de substitution surtout quand les gains économiques réels seraient faibles.
Pr Alain Astier . - La prescription en DCI qui est prévue par la loi devrait régler un certain nombre de problèmes.
Par ailleurs, à l'hôpital, on ne connait pas toutes ces discussions autour des génériques, nous les utilisons largement et s'il existait le moindre problème, ça se saurait !
Même sur des produits à marge thérapeutique étroite, le générique est donc pleinement efficace et il permet des économies substantielles. S'il est évidemment nécessaire de prendre des précautions dans des cas tout à fait particuliers, une politique ne se fait pas sur de tels cas. Il me semble donc que la polémique est close.
Mme Annie David . - De manière préliminaire, je dois dire que je suis plutôt favorable à la politique du générique. Pour autant, il est nécessaire de s'assurer de la qualité de ces médicaments.
Devant la nécessité de transparence et pour instaurer de la confiance, les tests de bioéquivalence ne devraient-ils pas être rendus publics, notamment leurs conditions de réalisation et le lieu où ils l'ont été ? Les excipients sont-ils également testés à cette occasion ?
En ce qui concerne la fabrication, sommes-nous certains de la bonne qualité des matières premières qui servent de base au médicament ?
Vous nous avez indiqué qu'aucune étude n'indique que les génériques sont moins efficaces mais en existe-t-il qui démontrent qu'ils sont aussi efficaces ?
Je crois qu'un effort de pédagogie pourra nous permettre d'améliorer la confiance dans les génériques. Cela passe notamment par la formation des médecins qui devrait peut-être plus intégrer certaines notions de pharmacovigilance. Dans le même esprit, ne devrions-nous pas inviter les médecins à prescrire en DCI ?
Enfin, s'il est vrai, sur le papier, qu'on ne devrait pas reconnaître un médicament à sa couleur, le fait de changer de présentation est particulièrement déstabilisant, surtout lorsque le patient est amené à suivre plusieurs traitements simultanément, ce qui est fréquent chez les personnes âgées ou celles atteintes d'une maladie chronique. Ces changements n'incitent pas à accepter la substitution !
M. René-Paul Savary . - Vous avez parlé de l'empathie avec laquelle il fallait prescrire le générique. La pédagogie a également été évoquée mais l'un des arguments très convaincants réside dans le remboursement de l'assurance maladie... Le lien entre tiers-payant et refus du générique est d'une redoutable efficacité ! De telles mesures doivent donc être consolidées pour faire changer les mentalités.
Pour autant, le fait que le pharmacien change régulièrement le générique qu'il propose à un même patient pose un véritable problème. Les malades peuvent vite se perdre !
Nous faisons face à une multiplicité des génériques, avec des milliers de présentations : pour la très courante amoxicilline, il y a deux pages entières de versions différentes. De ce fait, les logiciels d'aide à la prescription sont de plus en plus complexes à utiliser. Comment faire de la bonne médecine si nous sommes amenés à devoir explorer longuement l'arborescence du logiciel ? Il faut être plus pragmatiques...
En ce qui concerne la formation des médecins, je crois que les chefs de service occupent une place essentielle : comment se fait-il que, même si le générique a été utilisé à l'hôpital, le patient en sorte avec une ordonnance qui contient le nom du médicament princeps !
En conclusion, nous avons plus besoin de changements pratiques et simples que de bouleversements pour mieux diffuser la culture du générique.
M. Philippe Leroy . - Je souhaite tout d'abord remercier la Mecss d'avoir organisé cette table ronde très intéressante et de m'avoir permis d'y participer. Je confirme que changer de présentation pose de réelles difficultés lorsque l'on prend plusieurs médicaments chaque jour. Je suis agronome et il me semble utile d'avoir une approche de ce sujet par la chimie. C'est le princeps qui a subi tous les tests avant l'autorisation de mise sur le marché. Il se trouve que ses copies ne ressemblent pas toutes à la molécule initiale. Il peut y avoir des sels différents et on peut ainsi passer d'un chlorure à un sulfate, ce qui change la molécule. Cela me choque d'autant plus que les génériques ne font pas l'objet de tests cliniques, avez-vous dit. Il me semble donc nécessaire d'aller plus loin dans les analyses. La bioéquivalence me semble plus juridico-scientifique que réellement scientifique...
M. Gilbert Barbier . - Je souhaite évoquer un cas précis, voire emblématique. 500 millions d'euros par an, voilà ce que coûte à la sécurité sociale l'absence de substitution entre l'Avastin et le Lucentis. Plusieurs équipes ont expérimenté l'utilisation de l'Avastin pour traiter la dégénérescence maculaire liée à l'âge (DMLA) avec des résultats satisfaisants, tandis que l'Académie de médecine a émis des réserves. Ne serait-ce pas plutôt un problème pour les deux laboratoires concernés qui sont très liés et ne pourrions-nous pas régler cette question qui apparaît comme une exception française ?
Mme Laurence Cohen . - La France est le deuxième pays où le prix des génériques est le plus élevé. Quel levier pouvons-nous utiliser contre cela ?
Par ailleurs, certains professionnels ont été amenés à exprimer des réserves car les contrôles des médicaments génériques ne seraient pas suffisamment poussés par rapport aux princeps.
Sur certains individus, le générique va avoir moins d'effets que le princeps, ce qui entraîne une limite importante, d'autant que les patients peuvent aujourd'hui se sentir contraints dans le choix du médicament.
M. Alain Milon . - Je voudrais illustrer nos débats par une expérience. Je connais une personne de soixante-dix ans qui avait des problèmes gastriques, elle a été soignée et a guéri. Son médecin renouvelle son ordonnance, sans apposer la mention « non substituable », et le pharmacien délivre des génériques. Les douleurs à l'estomac reprennent tant et si bien que le médecin prescrit à nouveau des examens, qui ne donnent rien. Le médecin rédige une nouvelle ordonnance en oubliant l'un des médicaments précédents. La personne n'a plus mal à l'estomac mais se rend compte qu'il manque un médicament par rapport à d'habitude. Le médecin le lui prescrit ; le pharmacien lui délivre le princeps, cette fois. Les douleurs ne reviennent pas.
S'il existe bien une bioéquivalence, cet exemple montre qu'il y a quand même un problème ! Et il n'est pas seulement psychosomatique car la personne en question ne s'était pas rendu compte de la substitution ou de l'absence de l'un des médicaments.
M. Louis Pinton . - J'ai également vécu une expérience, en tant que vétérinaire, qui montre qu'il faut faire très attention avec les médicaments. Pour soigner 22 cochons malades, j'ai été amené à leur injecter séparément deux antibiotiques que j'avais l'habitude d'utiliser sous la forme d'une solution unique. Le résultat fut dramatique : les cochons sont tombés raides morts les uns après les autres ! Il se trouve qu'un caillot se formait quand les produits se rencontraient dans le corps, problème qui n'existe pas quand le produit est préalablement conditionné. Le mode de préparation, comme les excipients, comptent donc pour beaucoup.
M. Dominique Maraninchi . - Revenons aux fondamentaux : il existe des variations entre individus en ce qui concerne la distribution ou l'absorption de médicaments, que ce soient des princeps ou des génériques. Nous ne sommes malheureusement pas égaux face à cela ! C'est ce que nous appelons la biodisponibilité ; elle concerne tout médicament. Manifestement, elle concerne aussi les cochons, qui par ailleurs semblent mal supporter le poison...
La bioéquivalence est quelque chose de tout à fait sérieux et l'opposabilité que j'évoquais précédemment n'est pas seulement juridique, elle est aussi scientifique. Surtout, elle est opposable sur le plan réglementaire vis-à-vis des fabricants, ce qui est essentiel dans le cadre du contrôle de la qualité des produits.
En ce qui concerne les excipients, c'est un peu la même chose : il en existe dans tous les médicaments ! Ils sont indispensables pour la préparation du produit, notamment pour les comprimés. Certains excipients ont des effets dits notoires, par exemple en termes d'allergies. Encore une fois, ceci concerne tous les médicaments, qu'ils soient princeps ou génériques.
Nous sommes extrêmement attentifs à ce que la biodisponibilité du générique soit strictement identique à celle du princeps ; nous évaluons la totalité du produit, pas seulement la molécule active, et ceci en vie réelle.
M. Leroy évoquait le secteur phytosanitaire. Il existe aussi des problèmes de stabilité dans le temps des principes actifs, cela fait partie des éléments que nous contrôlons ; pour les médicaments, nous travaillons sur les molécules. Les pharmaciens responsables, dans les laboratoires pharmaceutiques, sont comptables de la bonne fabrication et de l'évolution du produit dans le temps, que ce soit pour un princeps ou un générique.
Il existe des secteurs de la santé où les contrôles sont beaucoup moins rigoureux que pour les médicaments, par exemple en ce qui concerne les dispositifs médicaux.
Faire des études d'efficacité pour des raisons psychologiques ou d'acceptabilité sociale : pourquoi pas ? Mais des ressources importantes devraient y être affectées ! Il ne faut pas en rajouter au risque de continuer à faire planer des doutes qui n'ont aucun fondement. En ce qui concerne l'ANSM, nous traitons avec équité tous les médicaments.
La question relative à l'Avastin et au Lucentis ne relève pas des médicaments génériques : ce sont deux médicaments radicalement différents et aucun pays n'autorise la substitution de l'un à l'autre. Pour les médicaments génériques, nous vérifions bien qu'ils n'apportent pas un risque supplémentaire par rapport au princeps, via la notion de bioéquivalence ; or, les données existantes de pharmacovigilance montrent une plus grande toxicité de l'Avastin par rapport au Lucentis dans le traitement de la DMLA. Les changements de traitement pour de seules raisons économiques et en face d'une toxicité plus élevée doivent être évalués très attentivement. L'utilisation de l'Avastin à la place du Lucentis a débuté aux Etats-Unis, pays où les patients payent très largement leurs traitements ! Ceci explique peut-être cela...
En outre, ce sont des médicaments biologiques, et non chimiques ; de ce fait, ils n'entrent pas dans la définition des médicaments qui peuvent être « génériqués ». Nous allons prochainement publier un rapport sur la question des médicaments biologiques, dont certains tomberont dans les prochaines années dans le domaine public et pourront ainsi faire l'objet de médicaments dits biosimilaires, ce qui constituerait alors une source d'économies importantes pour l'assurance maladie.
M. Gilbert Barbier . - Mais les Etats-Unis utilisent bien l'Avastin pour la DMLA ?
M. Dominique Maraninchi . - Je le redis : ce ne sont pas les mêmes molécules.
Pr Alain Astier . - Chimiste de formation, je souhaite indiquer à M. Leroy que le problème réside dans la partie active du médicament, que ce soit un sel - sous une forme ou sous une autre -, un ion ou toute autre chose. L'approche par la bioéquivalence répond tout à fait à la problématique qu'il soulève, puisqu'il s'agit de mesurer effectivement la dispersion dans l'organisme du principe actif. L'ensemble du médicament est testé dans sa globalité, excipients compris.
En ce qui concerne les prescriptions hospitalières de sortie, il s'agit d'un vrai problème. Les prix sont différents à l'hôpital et en officine et il peut arriver que nous utilisions le médicament le moins cher dans l'établissement et que le médecin prescrive un produit nettement plus cher en sortie d'hospitalisation. Cette prescription, qui dépend uniquement du médecin hospitalier, non du pharmacien de l'établissement, devrait mieux prendre en compte le rapport coût - bénéfice.
Pr Jean-Paul Tillement . - Je suis pleinement d'accord avec le Professeur Astier en ce qui concerne les sels mais il existe des cas où des évaluations précises doivent être menées, par exemple en ce qui concerne les acides qui salifient.
Nous sommes face à un problème moins de transparence, qui existe bien, mais plutôt de pédagogie. Ainsi, au niveau de la formation des médecins, il est indispensable d'augmenter le nombre d'heures d'enseignement en pharmacologie, car ce sujet est nettement plus complexe qu'auparavant, ne serait-ce qu'avec le développement du nombre de médicaments et de leurs modalités d'action.
Pour revenir à la question de la bioéquivalence, nous devons être conscients qu'il y aura toujours une variabilité selon la personne qui « reçoit » le médicament, qu'il soit générique ou princeps. La même dose n'a pas le même effet selon les individus ; pire, l'effet peut différer pour un même individu selon le moment où il prend le médicament. J'estime donc qu'au fond, la bioéquivalence est un faux problème.
Enfin, pour confirmer ce que j'indiquais précédemment, il est préférable de s'en tenir au même médicament pour un traitement. En toute rigueur, nous devrions procéder à des études de bioéquivalence entre les génériques d'un même princeps car la véritable question réside dans la variabilité entre individus.
M. Dominique Maraninchi . - La transparence est la meilleure réponse à la désinformation. Nous souhaitons d'ailleurs rendre publics les différents éléments dont nous disposons mais certains laboratoires pharmaceutiques ont engagé un contentieux au niveau européen pour éviter la diffusion des essais cliniques, ce qui nous empêche aujourd'hui d'aller plus loin. Je ne désespère pas de diffuser plus de données que ce que nous faisons déjà aujourd'hui mais il faut attendre la fin de ce contentieux. Cela révèle d'ailleurs l'ampleur des intérêts économiques en jeu. Pourtant, en ce qui concerne les génériques, ce ne serait pas compliqué puisqu'il s'agirait uniquement des tests de bioéquivalence.
Par ailleurs, la comparaison des génériques entre eux ne pose pas de problème de fond mais nécessiterait de l'argent et, surtout, ne donnerait pas de réponse particulière puisqu'ils sont identiques !
La Cnam a voulu démontrer, de manière originale, que la substitution de la simvastatine produisait le même effet thérapeutique tant en termes d'efficacité que de tolérance. L'étude est extrêmement concluante et permet, à mon sens, de lever les résistances : à partir des données relatives à de très nombreux patients, on constate que le princeps et ses génériques ont le même effet.
Enfin, nous devons toujours avoir à l'esprit que chacun a une histoire médicale complexe. Tous les médicaments, princeps ou génériques, peuvent produire des effets secondaires. Je rappelle que le signalement de ces phénomènes intéresse particulièrement l'ANSM au titre de la pharmacovigilance ; pour mémoire, nous avons reçu 38 000 signalements l'an passé, soit 20 % des signalements en Europe. Ils ont contribué à rendre les données transparentes, ce qui est essentiel dans ce domaine.
« EVALUATION DE LA POLITIQUE FRANÇAISE DU MÉDICAMENT GÉNÉRIQUE » : M. Claude BOUGE, directeur général adjoint du Leem - les entreprises du médicament ; M. Pascal BRIÈRE, président du Gemme (générique, même médicament) - Association des professionnels du médicament générique ; M. Dominique GIORGI, président du Comité économique des produits de santé (Ceps) ; M. Sylvain PICARD, inspecteur général des affaires sociales, co-auteur du rapport de l'Inspection générale des affaires sociales sur l'évaluation de la politique française des médicaments génériques ; Mme Mathilde LIGNOT-LELOUP, directrice déléguée à la gestion et à l'organisation des soins de la Caisse nationale d'assurance maladie (Cnam)
M. Yves Daudigny, président . - Cette seconde table ronde abordera l'évaluation de la politique française du médicament générique. Nous avons le plaisir d'accueillir Dominique Giorgi, président du comité économique des produits de santé (Ceps), Sylvain Picard, inspecteur général des affaires sociales (Igas), co-auteur du rapport sur l'évaluation de la politique française des médicaments génériques, Pascal Brière, président du Gemme, Claude Bougé, directeur général adjoint du Leem, et Mathilde Lignot-Leloup, directrice déléguée à la gestion et à l'organisation des soins de la Caisse nationale d'assurance maladie des travailleurs salariés (Cnam).
La première table ronde portait sur l'équivalence entre les médicaments princeps et génériques. Celle-ci permettra de débattre des objectifs, de la méthode, des résultats et des améliorations possibles de la politique française du médicament générique.
M. Sylvain Picard, inspecteur général des affaires sociales . - Le rapport de l'Igas de septembre 2012 a en effet examiné la politique française des médicaments génériques, qui s'est développée comme un outil de régulation des dépenses de médicaments. Les objectifs poursuivis sont divergents voire contradictoires, puisqu'il faut tenir compte à la fois des intérêts des laboratoires, qui investissent des sommes importantes dans l'innovation, et de la maîtrise des dépenses de santé, tout en sensibilisant les professionnels et les patients. En France, le prix des médicaments génériques n'est pas formé par le libre jeu de l'offre et de la demande, compte tenu de l'instauration de mécanismes de décote fixés par rapport au princeps. La volonté initiale des pouvoirs publics de mobiliser les médecins n'a pas été couronnée de succès. Ils se sont alors appuyés sur les pharmaciens, ce qui a été mal vécu par le monde médical, d'où aujourd'hui encore des réactions fréquemment défavorables des médecins à l'égard des génériques, même si celles-ci sont peu étayées par des arguments scientifiques valables.
La consommation de génériques est inférieure en France à celle des autres pays européens, avec un essoufflement marqué à partir de 2008. Comment expliquer cette situation ? Je pense tout d'abord que l'argument du moindre coût des génériques n'était pas forcément le meilleur moyen de rassurer les patients, enclins à établir spontanément un lien entre la valeur d'un bien et son prix... En outre, les médecins, insuffisamment associés au dispositif, ont peut-être été influencés par une information quelque peu partisane, ce qui n'a pas contribué, là non plus, à rassurer les patients. Par ailleurs, les laboratoires qui n'avaient pas intérêt à voir se développer les génériques ont tout d'abord tenté de gagner du temps par des procédures judiciaires et ont parfois ciblé les leaders d'opinion du monde médical, notamment les professeurs de centres hospitaliers universitaires (CHU). Pour atteindre en bout de chaîne les médecins généralistes, diverses méthodes ont été utilisées, la plus connue étant la vente à bas prix de médicaments princeps aux établissements de santé, ce qui permet d'orienter structurellement les prescriptions tant hospitalières qu'ambulatoires.
En outre, deux polémiques ont porté préjudice aux génériques.
S'agissant de la notion de bioéquivalence, on entend régulièrement des médecins déplorer que la disponibilité dans le sang du principe actif des médicaments génériques peut varier entre moins 20 % et plus 25 % par rapport à celle du princeps. Mais cet intervalle de confiance statistique n'est pas spécifique aux médicaments génériques et n'a rien à voir avec la disponibilité plasmatique du produit. L'efficacité d'un médicament, qu'il soit générique ou non, peut varier de 3 % à 5 % et dépend surtout, on le sait, de la variabilité individuelle. Par conséquent, ce procès fait aux médicaments génériques d'avoir des taux plasmatiques qui varient énormément par rapport aux princeps est un mauvais procès.
Autre polémique déplacée, la question des excipients à effets notoires, qui se pose exactement dans les mêmes termes pour tous les médicaments. Autrement dit, les médicaments génériques ne sont pas fabriqués avec des sous-excipients de moins bonne qualité. Ce sont les mêmes excipients et il faut prendre les mêmes précautions, que ce soit un générique ou un princeps.
Nous avons examiné dans notre rapport pratiquement toutes les études rédigées en français et en anglais sur les médicaments génériques. De cette méta-analyse, nous pouvons conclure qu'il n'y a pas de supériorité des princeps sur les génériques, mais que le changement de médicament, quelle que soit sa nature (substitution d'un générique à un princeps, substitution d'un princeps à un générique ou encore remplacement d'un générique par un autre générique), entraîne toujours des risques, souvent d'ordre psychologique - c'est ce qui est appelé l'effet nocebo.
La difficulté vient de ce que des patients souffrant de maladies chroniques ou traités pour des facteurs de risque (cholestérol, hypertension par exemple) ont suivi, parfois pendant des décennies, le même traitement. Or, aujourd'hui, les repères sont brouillés car un patient, tout en conservant la même molécule active, peut changer de génériques tout simplement en changeant de pharmacie.
Les études de bioéquivalence, réalisées majoritairement par des centres cliniques en Asie sur un panel de douze à trente-six volontaires sains, suscitent deux types d'interrogations. Les caractéristiques des individus de ce panel, par exemple leur poids ou leur mode de vie, n'entrainent-elles pas un biais par rapport au public occidental ou français ? Ces centres sont-ils suffisamment contrôlés ? Bien souvent, ils ne subissent qu'un seul contrôle de l'agence de sécurité sanitaire, sauf si l'inspection a révélé des problèmes. C'est pourquoi l'agence américaine compétente, la FDA (Food and Drug Administration), a ouvert l'an passé trois centres en Chine pour avoir des bases d'inspection opérationnelle réparties sur le territoire. Même si aucun problème réel n'a été aujourd'hui constaté, il est souhaitable que l'Europe, sous l'égide de l'Agence européenne des médicaments, développe également le contrôle des entreprises à l'étranger, et notamment de leurs sous-traitants.
Parmi les principales préconisations du rapport, il convient d'insister sur la nécessité d'augmenter la décote de 20 % pour le prix du princeps lorsque le brevet est tombé, car les coûts de développement sont alors largement amortis. Il faut également lutter contre les règles tarifaires avantageuses indûment accordées aux médicaments « me too », qui sont souvent de fausses innovations modifiant à la marge la composition d'un princeps, et dont l'amélioration du service rendu est faible, comme en témoignent deux récentes molécules dont je tairai le nom...
Ensuite, comme on l'a vu, il faut agir auprès des pharmaciens pour promouvoir la stabilité de la délivrance des génériques, pas seulement pour les personnes de plus de soixante-quinze ans, mais pour tous les patients. Le risque est faible, mais le changement de médicaments pourrait un jour aboutir à un accident dont on parlera beaucoup.
Il faut aussi encourager les médecins à recourir, lors de leurs prescriptions, à la dénomination commune internationale (DCI), ce qui est théoriquement obligatoire depuis 2009 lorsqu'ils prescrivent dans le répertoire. Ceci nécessite la certification et la généralisation des logiciels d'aide à la prescription, ainsi que des subventions à leur acquisition, notamment au bénéfice des médecins généralistes, dont le spectre des pathologies à traiter est très étendu. La DCI devrait d'ailleurs apparaître de manière plus visible que le nom commercial du médicament sur les boîtes pour sensibiliser et habituer les patients.
Il faut enfin que l'Europe développe les inspections des centres cliniques situés à l'étranger et relocalise une partie de la production des matières premières des médicaments. De fait, 80 % des matières premières de médicaments sont aujourd'hui fabriquées à l'international, et notamment en Asie. Une telle relocalisation permettrait de lutter contre les phénomènes de rupture de stock et faciliterait les contrôles.
M. Claude Bougé, directeur général adjoint du Leem . - Mon organisation se reconnaît partiellement dans les analyses du rapport de l'Igas, car il n'y a pas, à nos yeux, d'essoufflement du marché du générique. La politique française du médicament générique est assez originale car elle cherche à intégrer quatre dimensions complémentaires : sanitaire, industrielle, économique et budgétaire.
Je voudrais tout d'abord dénoncer trois idées fausses.
Tout d'abord, il est inexact de dire que les génériques sont moins sûrs que les médicaments princeps. Le niveau de sécurité est le même pour tous les types de médicaments. Nous partageons donc les analyses de Dominique Maraninchi, directeur général de l'ANSM, sur le sérieux des autorisations de mise sur le marché des médicaments, y compris au sujet des sels et esters à effets significatifs différents, ou encore des excipients à effets notoires. Le répertoire assure quant à lui la sûreté des substitutions. La bioéquivalence est un critère objectif, défini et appliqué par l'Etat, en charge des politiques de santé publique. L'Etat est d'ailleurs présent à chaque étape, ce qui nous paraît très sage.
Ensuite, certains affirment que le marché du générique est moins développé en France qu'ailleurs en Europe. Oui, c'est vrai, mais cette situation s'explique par un démarrage plus tardif dans notre pays. Aujourd'hui, les génériques représentent 20 % du marché et trois boîtes sur dix vendues en ville. C'est donc une politique qui réussit. Il n'est pas impossible que le Leem ait tardé à soutenir le marché du générique... Certaines personnes présentes se rappellent peut-être des joutes d'une autre époque, qui n'ont justement plus lieu d'être aujourd'hui. Mais le Leem soutient dorénavant sans réserve les génériques, comme en témoigne une lettre envoyée il y a quelques mois au Gouvernement au sujet de la fameuse mesure « tiers payant contre génériques », dans laquelle le président de notre organisation ne revient pas sur la légitimité de cette mesure et reconnaît que « le développement des génériques constitue un atout de la soutenabilité du système d'assurance maladie ». Comment peut-on parler d'essoufflement du marché du générique alors que le marché croît chaque année de 10 % à 20 % ?
Troisième idée fausse : les prix des génériques seraient plus élevés. Tous les gouvernements depuis quinze ans ont assis la rémunération officinale sur le segment du générique en autorisant des marges ou des remises nettement plus importantes que sur le princeps. Compte tenu de l'étroitesse de ce segment de marché, il n'est guère étonnant que le prix public des génériques soit souvent plus élevé que dans les pays voisins. Le prix industriel est-il plus élevé qu'ailleurs ? Cela peut arriver ici ou là. Mais il faut se référer aux prix des génériques établis le plus récemment, et non antérieurement à 2013, au risque d'avoir une vue biaisée de la situation et de passer à côté des effets de la politique de prix drastique menée depuis cinq à six ans sur le répertoire. S'agissant de la décote qui fixe le prix industriel du générique par rapport à celui du princeps, je rappelle qu'elle est passée, il y a un an, de 55 % à 60 % et qu'elle avait déjà grimpé régulièrement dans les années précédentes. La décote de 20 % a été instaurée en 2007-2008 et je ne sais pas si elle s'applique encore à certains produits.
M. Yves Daudigny, président . - Pour la clarté de nos débats, cette décote de 20 % porte bien sur le prix des médicaments princeps dont le brevet est tombé ?
M. Claude Bougé . - Oui, c'est exact, une telle décote a été instaurée sur le princeps, à partir du moment où ses génériques arrivent sur le marché.
En conclusion, nous estimons que les économies liées aux médicaments génériques sont encore devant nous, à la fois en raison de prix publics élevés par rapport aux prix industriels et d'un potentiel de progression sur les volumes, à condition de ne pas bouleverser l'équilibre de la politique actuelle et de travailler dans la confiance avec l'ensemble des acteurs.
M. Pascal Brière, président du Gemme . - La politique du générique en France est avant tout un grand succès. Pourtant, elle n'a véritablement démarré qu'en 1999 avec le droit de substitution, accordé aux pharmaciens par le ministre de l'époque, Bernard Kouchner, après l'échec de la politique précédente visant à imposer aux médecins de prescrire des génériques. La position des médecins à l'égard de ces médicaments n'a finalement pas vraiment évolué depuis, si l'on en juge par les prises de position rapides sur l'affaire du Furosémide. Certains ont très vite décrété qu'il s'agissait de génériques, dans leur esprit nécessairement produits en Asie, alors que l'usine concernée se situe à Sens, ville de Chine centrale comme chacun le sait ! En outre, cette usine est approvisionnée par des usines européennes.
Le marché du générique représente certes 20 % du marché en valeur et 27 % en volume mais, lorsque le produit n'est plus breveté, les génériques représentent 80 % des boîtes vendues : peu de pays peuvent se targuer d'atteindre un tel niveau.
Sur le plan sanitaire, cette politique est également un succès, car on n'a jamais eu vent d'un problème réel de tolérance ou d'effets secondaires de ces médicaments, alors que près de 800 millions de boites de génériques sont vendues chaque année dans notre pays. Dans l'exemple récent du Furosémide, qui est très vraisemblablement une fausse alerte, les informations sont remontées en quatre heures seulement à l'ANSM, qui a alors décidé de retirer les produits du marché.
Je remarque que le débat sur la bioéquivalence des génériques ne se pose qu'en France. Je rejoins ici les propos tenus par Sylvain Picard. Peut-être trouve-t-il sa source dans la mise à l'écart des médecins qui a certainement suscité une forme de ressentiment, par conséquent, un déficit d'information des patients et un sentiment de défiance à l'égard des génériques. Les patients doivent être rassurés par leurs médecins sur ces médicaments. Je voudrais dire aux médecins enclins à critiquer les génériques qu'ils doivent, en tout état de cause, faire remonter les éventuels effets secondaires des médicaments au titre des règles de pharmacovigilance qui s'imposent à tous.
Je crois également que les économies sur le générique sont devant nous. Pour cela, il faut rétablir la confiance à travers des actions de communication, comme le souhaitent l'Igas, l'ANSM et les syndicats de pharmaciens. Voilà un an que nous le demandons aussi, mais les pouvoirs publics semblent sourds à nos appels.
Si on atteignait 50 % de génériques, on dégagerait deux milliards d'économies supplémentaires par an. Il faudrait pour cela que la moitié des prescriptions médicales se porte sur des médicaments pour lesquels existent des génériques. Or, actuellement, 70 % de la consommation pharmaceutique porte sur des médicaments encore protégés par des brevets. Le problème ne vient pas d'une durée des brevets plus longue en France qu'ailleurs, mais de la propension des médecins à prescrire majoritairement des médicaments récents qui leur paraissent plus innovants.
La Cnam a par exemple réalisé une étude sur les statines, utilisées pour traiter le cholestérol. Au moment de l'introduction des génériques de deux médicaments largement utilisés jusqu'alors, les médecins ont massivement reporté leur prescription sur le Crestor, nouveau venu sur le marché. Pourtant, le service médical rendu de l'ensemble de ces médicaments est tout à fait équivalent et le prix du nouveau est de 30 euros, contre 10 euros pour le générique des deux précédents...
L'enjeu économique consiste donc à avoir une prescription efficiente : utiliser les génériques lorsqu'on le peut et conserver les produits d'innovation à leur juste place. En France, nous avons une énorme réserve en termes de prescriptions.
Mme Mathilde Lignot-Leloup, directrice déléguée à la gestion et à l'organisation des soins de la Caisse nationale d'assurance maladie des travailleurs salariés (Cnam) . - Du point de vue de l'assurance maladie, les médicaments génériques constituent un enjeu économique pour la maîtrise des dépenses de santé. En 2012, ces médicaments ont ainsi permis une économie de 1,5 milliard d'euros, plus importante que les années précédentes grâce à une progression du taux de substitution : il est passé de 72 % en avril 2012 à 84 % à la fin de l'année. Nous avions déjà connu de tels taux dans le passé mais on avait effectivement observé un essoufflement depuis 2008-2010 comme l'a indiqué le rapport de l'Igas.
Quels sont les leviers à notre disposition pour promouvoir les génériques ?
Tout d'abord, nous avons passé une nouvelle convention avec les pharmaciens en 2012 et la mesure « tiers payant contre génériques », permise par le Parlement dès 2007 et réactivée à cette occasion, a eu un effet notable auprès des assurés. Son application n'était pas homogène sur le territoire. Dorénavant, dès qu'un patient refuse la délivrance d'un générique, il a le droit de recevoir le princeps mais il ne bénéficie alors plus du tiers payant, et se trouve donc remboursé seulement a posteriori. Ce dispositif comporte évidemment des exceptions pour les médicaments aux marges thérapeutiques étroites, en ce qui concerne l'épilepsie par exemple.
Il est accompagné plus généralement d'une part de rémunérations sur des objectifs de santé publique pour les pharmaciens et d'un engagement de ne pas changer de traitement et de marque de générique, afin d'éviter les risques de confusion chez les patients âgés, habitués à la forme et à la couleur de leurs cachets. L'an dernier, 85 % des pharmacies ont respecté cet engagement. Nous avons récemment signé un nouvel accord avec la profession pour 2013.
Deuxième levier : les médecins. A partir de 2009, le contrat d'amélioration des pratiques individuelles (Capi) a fixé des objectifs aux médecins traitants pour prescrire dans le répertoire des médicaments génériques. Nous avons généralisé cette mesure dans la nouvelle convention médicale au titre de la rémunération sur objectifs.
L'action auprès des médecins est effectivement plus récente. Nous suivons attentivement les indicateurs fixés dans la convention, nous présentons aux médecins leurs profils individualisés et leur rappelons les objectifs. Les résultats sont concluants, la prescription dans le répertoire des généralistes a augmenté : plus seize points pour les statines, plus douze points pour les inhibiteurs de pompe à protons (IPP).
Nous avons également développé les aides à l'équipement pour que les médecins se dotent d'un logiciel d'aide à la prescription. Le nombre de logiciels certifiés par la Haute Autorité de santé (HAS) est parallèlement passé de deux à vingt-six.
Malgré ces efforts, le taux d'utilisation des génériques reste très en deça de ceux observés dans d'autres pays. Alors que leur taux d'utilisation pour les statines varie selon les produits entre 38 % et 54 % en France, il atteint quasiment 99 % en Allemagne.
Autre élément à signaler : des études réalisées en 2012 en vie réelle ont montré qu'il n'y avait pas de différence de morbi-mortalité ou d'efficacité entre les princeps de simvastatine et leurs génériques. Plus récemment, en mai dernier, nous avons publié une comparaison entre la rosuvastatine, la seule statine qui n'a pas de générique, et l'ensemble des autres statines. Sur 165 000 personnes observées pendant trois ans, aucune différence n'est à signaler entre ces molécules en termes d'efficacité. Malgré cette équivalence d'efficacité, on constate des différences de prescription très nettes entre la France et les autres pays européens.
Le prix des génériques demeure plus élevé dans notre pays qu'à l'étranger et, on l'a vu, les médecins français ont davantage tendance à prescrire des médicaments en dehors du répertoire, par attrait pour la nouveauté, que leurs homologues européens. En 2012, le coût moyen du générique est de 15 centimes d'euros en France, contre 12 centimes en Allemagne et nettement moins dans d'autres pays. Un alignement des prix sur l'Allemagne permettrait une économie de 400 millions d'euros. Dans cette optique, des décisions ont été prises par les pouvoirs publics pour augmenter la décote sur les princeps et baisser les prix des génériques.
S'agissant des structures de prescription, l'étude précitée sur la rosuvastatine a montré que cette molécule était utilisée dans seulement 0,5 % des volumes en Allemagne, moins de 4 % en Angleterre, mais 30 % en France, ce taux atteignant même 35 % en initiations de traitement et 45 % pour les prescriptions des cardiologues. Cette différence dans les prescriptions entraîne des coûts de traitements élevés, sans que l'on ait forcément des gains en termes d'efficacité et de santé pour les patients.
Au final, si on avait, pour les statines, les mêmes structures de prescription et les mêmes prix qu'en Allemagne, on dégagerait une économie de 500 millions d'euros, dont 300 millions grâce au seul effet prix et 200 millions d'euros pour l'effet structure.
Il faut donc agir en amont, dès l'hôpital, où se font en général les initiations de traitement, ainsi qu'auprès des spécialistes. On a commencé à le faire en 2012 avec les cardiologues, à travers une rémunération sur objectifs qui n'a commencé à faire sentir ses effets qu'en septembre dernier.
Pour l'assurance maladie, le développement des génériques constitue un enjeu majeur et l'engagement doit être poursuivi auprès de l'ensemble des professionnels, notamment auprès des médecins.
M. Dominique Giorgi, président du comité économique des produits de santé (Ceps) . - L'économie du médicament générique se concentre autour de quatre déterminants : le périmètre, c'est-à-dire la surface du répertoire et dans quelles conditions il est possible d'y entrer ; le volume, c'est-à-dire le taux de substitution ; la prescription ; le prix.
Il faut rappeler que la France, qui a fait des progrès significatifs ces dix dernières années, malgré un essoufflement entre 2008 et 2012, reste loin du compte par rapport à certains de nos voisins. Dans notre pays, les génériques représentent, en valeur, 20 % du marché et 27 % des boîtes vendues, alors qu'en Allemagne ils comptent pour 35 % à 40 % du marché et les deux tiers des boîtes vendues. La marge de progression est donc très importante.
L'année 2012 a été marquée par un pic de générication considérable, qui n'est malheureusement pas reproductible : les prochaines années verront le retour d'un chiffre d'affaires des médicaments entrant dans le répertoire qui ne dépassera pas 350 millions d'euros par an, avec une stagnation en 2016 des entrées dans le répertoire. Celui-ci continuera à se développer normalement, sans reproduire les résultats de l'an passé.
Entre 2008 et 2012, le taux de substitution a régressé, passant de 82 % à 72 %. La mesure « tiers payant contre génériques » a eu des effets spectaculaires, puisque le taux de substitution se situe à nouveau entre 83 % et 84 %. C'est un mécanisme d'intéressement des pharmaciens d'officine, dont une part de la rémunération varie en fonction de l'atteinte des objectifs fixés par la convention signée avec la Cnam. Il fonctionne, mais va-t-on pouvoir maintenir ce niveau ou même encore progresser ? Un taux de 90 % n'est pas inenvisageable, dès lors que les efforts sont poursuivis.
Il y a un débat sur le niveau élevé des prix des génériques en France par rapport à ceux constatés dans d'autres Etats-membres de l'Union européenne comme l'Allemagne, le Royaume-Uni ou les Pays-Bas. De nombreuses études ont été réalisées, en particulier par la Cnam ; certains les contestent, ce qui n'est pas mon cas. D'où viennent ces différences ? Tout d'abord du modèle d'achat public. Nos voisins achètent en gros, sur la base de procédures similaires à des appels d'offres nationaux (Allemagne, Pays-Bas) ou par le biais de chaines de pharmacies très puissantes (Royaume-Uni), regroupant plusieurs dizaines ou centaines d'établissements et dont la capacité d'achat est très importante. C'est un modèle économique différent de la fixation administrée des prix qui prévaut en France.
La seconde raison est illustrée par la décomposition analytique du coût d'un médicament générique. Depuis 1999, les pouvoirs publics font reposer la politique de développement des génériques sur le pharmacien d'officine. Il est intéressé à la substitution : le tiers payant contre génériques en est le dernier épisode. La marge d'un médicament générique n'est pas calculée sur la base du prix du fabricant de ce médicament mais sur celle du princeps. Il est donc beaucoup plus intéressant d'avoir une marge sur le générique que sur le princeps. Par ailleurs, entre le prix public et celui du fabricant, les « marges arrières » sont plafonnées à 17 % pour les génériques depuis la loi Chatel de 2008, tandis qu'elles sont de 2,5 % pour les princeps. En sus, des coopérations commerciales existent souvent : une part significative du prix fabricant hors taxes revient donc au pharmacien d'officine. J'y vois potentiellement une des raisons de l'écart de prix entre la France et certains pays étrangers concernant les génériques. Des études approfondies sont sans doute nécessaires, mais ce sujet devra être traité.
Plusieurs facteurs pourraient expliquer ce prix plus élevé des génériques.
Est-ce lié aux marges des fabricants ? Il semblerait que la rentabilité des génériqueurs français soit comparable à celle de leurs concurrents. Le prix de revient industriel serait-il différent entre fabricants français et étrangers ? C'est peut être une explication : le recours au marché dans un cadre très concurrentiel, comme aux Pays-Bas ou au Royaume-Uni, incite les génériqueurs à importer leurs produits plutôt qu'à les produire localement. Pour un euro, quelques centimes sont sans doute économisés de cette façon, mais cette technique a des conséquences en termes de coûts supplémentaires, par exemple de transport, de situation sociale et de confiance dans les médicaments qui dépassent un cadre purement économique. En France, les pouvoirs publics sont aujourd'hui attachés à une production avant tout européenne, ce qui est aisément compréhensible.
Enfin, les coûts de distribution sont-ils trop élevés ? Je pense que c'est un facteur important de l'écart des prix des génériques entre la France et l'étranger. Le mode de rémunération des pharmaciens d'officine doit être examiné. En France, ils sont rémunérés plus que proportionnellement au prix du générique. En Allemagne, au contraire, la déconnexion est totale. Les pharmaciens sont rétribués au forfait, à la boîte, que ce soit un générique ou un princeps. Au Royaume-Uni, 80 % de la rémunération des pharmaciens est liée à la délivrance du médicament, c'est-à-dire à la feuille de soins. Seulement 20 % sont liés à la distribution directe du générique.
Le Ceps s'est saisi depuis plusieurs années de la question du prix des génériques. Le prix ab initio est aujourd'hui fixé en appliquant une décote de 60 % par rapport au prix du princeps. Au bout de dix-huit mois, si le taux de substitution est jugé insuffisant, une seconde baisse de 12,5 % est appliquée. Le prix du stock des médicaments génériques est également examiné. En octobre 2012, lors d'un comité de suivi des génériques, une baisse de prix a été décidée après comparaison avec les prix européens. Cette mesure rapporte 90 millions d'euros en année pleine. En septembre prochain, nous renouvellerons la procédure, avec un impact financier similaire. Nous réalisons également des mesures de classes : l'an dernier les inhibiteurs de la pompe à protons, cette année les statines. Dans ce cas, les princeps génériqués et les génériques correspondant font l'objet d'une baisse de prix. Enfin, des baisses peuvent être décidées au fil de l'eau, dans le cadre de l'activité générale du Ceps. Au total, entre 150 et 200 millions d'euros ont été économisés. Notre cible est le niveau de prix allemand, 20 % inférieur au nôtre. Nous nous en approchons progressivement. La question des prix est donc traitée au fur et à mesure des générications mais également par le réexamen du stock des génériques.
Le rapport de l'Igas précise qu'une hausse d'un point de la substitution ferait économiser 14 millions d'euros à l'assurance maladie. La même hausse en matière de prescription dans le répertoire aurait comme conséquence une économie de 89 millions d'euros, soit nettement plus que les autres moyens d'action. Voilà donc le facteur sur lequel il faut agir pour tirer le meilleur profit pour l'assurance maladie du développement des génériques. De nombreuses propositions en ce sens ont été faites ; certaines commencent à être mises en oeuvre afin de favoriser la prescription dans le répertoire. C'est le cas du contrat d'amélioration des pratiques individuelles (Capi), mais on pourrait également imaginer un système de bonus-malus. Le développement de la prescription en dénomination commune internationale (DCI), éventuellement au moyen de logiciels d'aide à la prescription, serait également une solution. Les Suédois s'appuient, quant à eux, sur une liste de référence des produits usuels. Ne faudrait-il pas contrôler plus systématiquement les ordonnances où figure la mention « non substituable » ? A terme, pourquoi ne pas s'acheminer, comme l'Allemagne ou le Royaume-Uni, vers un objectif médicalisé de prescription pour chacun des prescripteurs, afin de les inciter à recourir davantage aux génériques. Ce dispositif est une des raisons pour lesquelles le marché des génériques y est aussi développé.
M. Yves Daudigny, président . - Il me semblait que la différence de prix constatée entre la France et le Royaume-Uni tenait en partie à la plus forte proportion de génériques qui sont produits dans notre pays. Nos prix plus élevés seraient liés à notre politique de soutien de notre industrie. Pouvez-vous préciser vos propos sur le sujet ?
Le répertoire prévoit la substitution d'un princeps par un générique. Qu'en est-il des classes, comme les statines ? Pouvez-vous nous expliquer les règles en vigueur en Allemagne, qui ne sont pas identiques aux nôtres ?
M. Gilbert Barbier . - Comment expliquer la différence de prix entre le bévacizumab et le ranibizumab, c'est-à-dire entre l'Avastin et le Lucentis, le second étant quarante fois plus cher que le premier, alors que ce sont des molécules voisines, qui ont les mêmes indications en matière de cancérologie. Les explications que nous a données Dominique Maraninchi lors de la précédente table ronde ne me convainquent pas. Le surcoût pour l'assurance maladie dans le traitement de la dégénérescence maculaire liée à l'âge (DMLA) est de 500 millions d'euros par an...
Mme Annie David . - Je suis déconcertée par les propos que je viens d'entendre. L'objet de cette table ronde est bien l'évaluation de la politique française du médicament générique, mais j'ai surtout entendu parler d'argent et peu des éventuels bienfaits pour les assurés sociaux. C'est une source d'économie pour la sécurité sociale, ce dont je me félicite car il est indispensable de consolider notre système de protection sociale. Néanmoins, l'amélioration de la santé des patients reste l'objectif essentiel. Je suis donc étonnée que la discussion ait surtout porté sur l'économie financière et non sur les résultats en matière de santé publique.
Je m'interroge sur la qualité de la matière première, thème qui n'a pas été traité jusqu'à présent. Que pouvez-vous nous en dire ?
J'ai de nombreuses pistes à vous proposer concernant la fixation des tarifs des médicaments, même si elles ne vous conviendront sans doute pas. Pourquoi autant de médicaments et de génériques sont-ils fabriqués ? Pour quelles raisons tant de choses sont-elles laissées à la discrétion de l'industrie pharmaceutique ? Ce n'est pas une industrie comme les autres, car elle mobilise beaucoup d'argent public et influence notre système de protection sociale. Il est donc essentiel de s'assurer que le coût des médicaments génériques soit tel que le gain pour l'assurance maladie soit maximal.
La rémunération des acteurs a été mentionnée à plusieurs reprises, que ce soit les pharmaciens d'officine ou les médecins avec le Capi. La prescription des génériques est donc un enjeu financier pour eux. Mais connaît-on vraiment les résultats de cette politique en matière de santé publique ? Quelles sont les avancées pour notre protection sociale et la santé des patients ?
La prescription en DCI serait possible grâce à des logiciels d'aide à la prescription certifiés. Toutefois, du fait de la multiplication de ces génériques, les médecins ont du mal à s'y retrouver, malgré l'usage de tels logiciels. Ne pensez-vous pas qu'il faudrait imposer certaines restrictions en matière de production des génériques ou, tout du moins, instaurer plus de cohérence afin que le travail de prescription des médecins soit facilité ?
La suppression du tiers payant lorsqu'un patient refuse un médicament générique me semble contradictoire avec les propos qui ont été tenus selon lesquels il n'est pas dans l'intérêt du patient de changer trop souvent de générique. Lorsqu'un patient se voit proposer un nouveau générique qui n'est pas le même que celui qu'il prenait auparavant, va-t-il perdre le bénéfice du tiers payant ?
L'industrie du médicament générique est bien différente de l'industrie automobile ou informatique, secteur dans lequel j'ai longtemps travaillé. Comprenez donc mon étonnement face au peu de cas fait de la santé publique, jusqu'à présent, dans cette table ronde.
M. René Teulade . - Une part importante des matières premières est produite en dehors de l'Union européenne, en particulier en Asie. Que faire pour que cette production soit rapatriée dans notre pays ?
M. Jean-Marie Vanlerenberghe . - Je pense qu'il est de notre devoir de contenir la dépense en matière de médicament. En France, la prescription tout comme la consommation sont d'ailleurs trop importantes. Les mesures pour diminuer la prescription, à destination des médecins, sont-elles efficaces ?
Au Royaume-Uni, il y aurait trois fois moins de médicaments inscrits au répertoire des produits remboursables par la sécurité sociale qu'en France. Cela contribuerait à une meilleure régulation du marché et améliorerait la situation financière de leur régime d'assurance maladie.
M. Pascal Brière . - Le marché anglais se caractérise par un système d'achat par le pharmacien et de fixation d'un tarif par la sécurité sociale en fonction des prix constatés à l'achat par les pharmaciens. Cela a provoqué une spirale de baisse des prix. En conséquence, l'industrie du médicament générique anglaise a progressivement disparu. La production indienne a remplacé la production anglaise. Aujourd'hui, en quantité, 95 % des médicaments génériques consommés en Angleterre sont importés d'Inde. Le pays est donc exposé à des ruptures de stock très importantes. Le marché est soumis à la loi de l'offre et de la demande. Lorsque des containers arrivent dans les ports anglais, l'offre est abondante et les prix baissent. A l'inverse, l'épuisement des stocks fait augmenter parfois drastiquement les prix. Rien n'empêche une hausse de prix de 300 % dans la semaine. L'assurance maladie anglaise réajuste alors le prix de remboursement.
La sécurité sanitaire et le suivi par le patient de son traitement sont très importants. Les patients atteints de maladies chroniques doivent toujours avoir le même médicament générique. C'est impossible dans le système anglais.
En France, 95 % des génériques distribués sont fabriqués dans notre pays ou en Europe. C'est une situation unique, qui s'explique par la densité de notre tissu industriel.
M. Gilbert Barbier . - Ne sont-ils pas juste conditionnés ?
Mme Annie David . - Et qu'en est-il de la matière première ?
M. Pascal Brière . - Je parle de la spécialité terminée, de la réalisation effective des comprimés, qui constitue la phase la plus importante de la production. L'industrie française du médicament est très développée et dispose de nombreuses usines, construites à l'époque où il était indispensable pour les industriels d'avoir une usine en France pour obtenir de bons prix auprès du prédécesseur du Ceps. Lors de la concentration des groupes pharmaceutiques, ces usines surnuméraires ont été reprises par des façonniers qui produisent les génériques vendus en France. Il y a donc un rôle social et sociétal du générique, qui se reflète dans son prix. Avec une libre concurrence absolue, les gagnants seraient hors des frontières européennes. La politique du générique conventionnelle comme celle en vigueur en France est moins défavorable aux industriels, tout en sachant que la rentabilité des laboratoires produisant des génériques n'est que de 2,8 %. Le gisement d'économies ne se situe donc pas dans les prix.
M. Claude Bougé . - A l'automne dernier, la dernière usine produisant des génériques sur le territoire britannique a fermé. Un ministre anglais l'a publiquement déploré.
M. Yves Daudigny, président . - Quel est le pourcentage des génériques produits en France ?
M. Pascal Brière . - Environ 55 % en nombre mais un petit peu moins en valeur car la réglementation européenne interdit aux fabricants de génériques de préparer le lancement de leurs nouveaux produits en Europe.
Les matières premières ne viennent pas majoritairement de Chine ou d'Inde. Ce sont des produits anciens, qui pour beaucoup sont importés d'Italie ou d'Espagne mais dont certains sont, il est vrai, fabriqués dans des pays plus éloignés. Toutefois, la qualité du médicament générique ne dépend pas tant de la qualité de la matière première que de la façon dont est fait le comprimé. La matière première est soumise à de nombreuses normes : celles du pays d'origine tout d'abord, puis l'inspection par les autorités européennes avant l'importation et enfin le contrôle par le fabricant qui applique la pharmacopée européenne. C'est seulement après ces différentes étapes que la matière première est utilisée. Une fois la fabrication du produit achevée, de nouveaux contrôles ont lieu, en plus de ceux réalisés tout au long de la chaîne.
De plus, la nouvelle directive européenne sur les principes actifs d'origine pharmaceutique, qui entrera en application le 2 juillet prochain, rend obligatoire pour tout principe actif d'être accompagné d'un certificat précisant que la matière première produite en dehors de l'Union européenne a été auditée par les autorités locales selon les critères européens. Le système est donc verrouillé. La preuve en est qu'en quinze ans, avec 800 millions de conditionnements délivrés aux patients chaque année, aucun problème sanitaire avec les médicaments génériques n'a été à déplorer.
M. Dominique Giorgi . - Je regrette de n'avoir pu parler davantage de santé publique dans mon exposé, mais le seul domaine que je connaisse suffisamment est celui de l'économie du médicament. Le Ceps est uniquement compétent pour fixer le prix des médicaments. De par mes fonctions de président, je suis garant du fait que l'introduction de médicaments génériques sur le marché français produira des effets économiques. Le Ceps intervient donc en aval du processus, d'autres acteurs sont chargés d'évaluer ces médicaments en termes de santé publique. Il s'agit notamment de l'ANSM que vous avez reçue pour votre première table ronde.
D'un point de vue économique, les génériques ont permis de réaliser en 2012 1,5 milliard d'euros d'économies. L'intervention du Ceps garantit que le prix d'un nouveau médicament générique soit fixé au plus juste par rapport au princeps, avec la décote de 60 %, et soit périodiquement réajusté afin que la collectivité achète ses médicaments au meilleur prix. Pour 2013, les baisses de prix sur les médicaments génériques existants se montent déjà à 150 millions d'euros, soit 5 % de ce marché de 3 milliards d'euros. Il en sera de même l'an prochain, et c'était déjà le cas l'an passé. Ces baisses de prix ne sont donc pas anodines.
Dans le dernier PLFSS, le Parlement a voté une disposition visant à étendre la recommandation temporaire d'utilisation (RTU) pour des motifs économiques, ce qui donne la possibilité de considérer comme équivalents des produits qui ne le sont pas. Entre l'Avastin et le Lucentis, le simple énoncé du nom des molécules prouve que ce ne sont pas les mêmes produits. Ils ne sont pas sortis en même temps et n'ont pas les mêmes indications thérapeutiques. Il y a un recoupement sur la DMLA, mais dans ce cas l'Avastin est prescrit en dehors de son autorisation de mise sur le marché (AMM). L'étude Gefal vient de montrer l'équivalence en termes de résultat et de tolérance entre ces deux médicaments. J'en prends acte, il faut désormais voir quelles conséquences les pouvoirs publics en tireront. Il n'est toutefois pas étonnant que les prix de ces produits, qui n'ont pas les mêmes indications ou les mêmes améliorations du service médical rendu, ne soient pas identiques. L'Avastin prescrit hors AMM est moins coûteux à l'usage que le Lucentis prescrit dans le cadre de son indication officielle. C'est un vrai sujet.
M. Gilbert Barbier . - Il est quarante fois plus cher !
M. Dominique Giorgi . - Je ne peux pas confirmer ce chiffre mais le Lucentis a fait l'objet d'une baisse de prix de 20 % en 2012. Il n'est pas exclu que ce produit soit à nouveau examiné l'an prochain. Toutefois, il est encore protégé par son brevet et est prescrit dans sa bonne indication. Nous sommes également obligés de tenir compte des effets des baisses de prix en France sur les prix internationaux. Les prix français sont référencés, il y a donc des répercussions importantes dont les industriels nous font part et qui font que, pour des produits protégés, des limites doivent être respectées.
M. Claude Bougé . - Pourquoi l'industrie accepte-t-elle les baisses de prix préconisées par le Ceps, la Cnam ou l'Igas ? Tout d'abord car il s'agit de baisses conventionnelles, négociées et progressives. Elles ne sont pas immédiates mais donnent lieu à un dialogue. Nous les contestons lorsqu'elles sont massives, mais je tiens à rappeler le soutien du Leem à la politique du générique, qui est une des conditions de la soutenabilité du système social français. Les combats théologiques de l'industrie sur ce sujet appartiennent au passé.
Il y a un corollaire à cette politique : l'accès large et rapide, médicalement justifié, des patients aux innovations. Elle doit leur permettre d'accéder au progrès thérapeutique, y compris international. De ce point de vue, nous avons de vraies inquiétudes : des produits innovants n'arrivent plus sur le marché, leur évaluation est faite de telle sorte que leur caractère innovant est nié, le Ceps fait des propositions qui sont incompatibles avec ce qui est acceptable pour une entreprise internationale et dont les produits pourraient être exportés. Un prix français artificiellement bas pourrait servir de base à un prix européen. Cette dimension ne doit donc pas être oubliée.
Mme Mathilde Lignot-Leloup . - Nous agissons en faveur du développement des génériques seulement lorsque ceux-ci produisent les mêmes effets pour le patient que le princeps. L'assurance maladie n'est pas responsable du contrôle de la sécurité des médicaments, qui est une des compétences de l'ANSM, mais elle mène des études, comme par exemple sur les statines en 2012, afin de vérifier que les génériques ont la même efficacité que les princeps. Nos dispositifs pour inciter médecins et pharmaciens à développer l'usage des génériques s'inscrivent dans le cadre d'un modèle où la sécurité du générique est contrôlée comme celle de l'ensemble des médicaments.
L'Allemagne utilise un prix de classe (Festbetrag) : les prix des médicaments d'une même classe sont alignés, ce qui produit d'importants effets en matière de maîtrise des prix. Certains pays ont expérimenté un budget global pour le prescripteur, où l'incitation ne repose pas uniquement sur les volumes mais également sur les prix, afin qu'il ait davantage recours au répertoire.
Les dépenses de médicament par habitant en France sont traditionnellement plus élevées que chez nos voisins. Sur la période 2007-2012, leur évolution a toutefois connu un ralentissement notable, que ce soit pour les princeps ou les génériques. Pour les principales classes thérapeutiques, qui représentent environ 38 % de la consommation française, la progression a été de 0,8 % alors qu'en Allemagne la hausse était de 3,4 %. Néanmoins, en volume, les dépenses restent plus élevées en France : nous restons le premier pays en termes de dépense de médicament par habitant, si on met à part le cas spécifique du Royaume-Uni, où la consommation de médicaments antiasthmatiques est très élevée.
Pour certains produits, comme les antibiotiques ou les benzodiazépines à destination des personnes âgées, cela soulève de vraies questions de santé publique. Ainsi, dans le cadre des objectifs que nous fixons aux médecins traitants, nous avons visé en 2012 une réduction du volume des antibiotiques prescrits aux personnes qui ne souffrent pas d'une affection de longue durée (ALD), en coordination avec la direction générale de la santé (DGS) puisque cette mesure s'inscrit dans la stratégie nationale de santé publique visant à réduire la consommation d'antibiotiques. Cette consommation a été un peu mieux maîtrisée grâce à cette initiative, bien qu'on constate encore des écarts importants sur le territoire et entre médecins traitants. Nous allons donc mettre en oeuvre des actions de pédagogie envers les prescripteurs et les informer de leur écart par rapport à l'objectif et par rapport à leurs confrères, afin de faire chuter la prescription d'antibiotiques. De même, pour les personnes âgées, nous avons obtenu des résultats en termes de moindre prescription de benzodiazépines mais pas sur la durée de traitement, qui reste un enjeu de santé publique. Il faut donc y travailler avec les prescripteurs, qu'ils soient en ville, en établissement d'hébergement pour personnes âgées dépendantes (Ehpad) ou à l'hôpital.
M. Yves Daudigny, président . - Si je vous ai bien compris, en Allemagne, tous les médicaments génériques d'une même classe sont au même prix. Qu'en est-il des princeps ?
Mme Mathilde Lignot-Leloup . - Il n'y a pas en Allemagne, à ma connaissance, cette notion de répertoire qui fait la distinction entre médicaments génériques et princeps.
M. Pascal Brière . - C'est un tarif de prise en charge par classe, une sorte de tarif forfaitaire de responsabilité (TFR) étendu à une classe homogène estimée équivalente. C'est une précision importante, car peu de produits remplissent cette définition. Un prix unique est donc établi pour une classe de produits dont les effets sont jugés équivalents.
M. Yves Daudigny, président . - Aussi bien pour les génériques que pour les princeps ?
M. Pascal Brière . - Oui, mais le laboratoire est ensuite libre de fixer le prix de son choix, au-dessus de celui de la classe, ce qui laisse un reste à charge aux patients. L'Allemagne n'est pas un pays où les prix des médicaments sont administrés.
M. Yves Daudigny, président . - Le patient n'est donc pas incité à acheter un générique ?
M. Dominique Giorgi . - L'incitation pèse plutôt sur le médecin, qui doit respecter son budget de prescription.
Mme Mathilde Lignot-Leloup . - Comme le décrit précisément le rapport de l'Igas, l'Allemagne a combiné des tarifs uniques pour des « jumbo class » et des budgets pour les prescripteurs. Ces deux instruments se sont succédé dans le temps, sans être antinomiques.
M. Pascal Brière . - Ces dispositifs sont venus se cumuler lorsque le marché des génériques a commencé à plafonner autour de 70 % et qu'il n'était plus possible de réaliser de nouveaux progrès en matière de prescription économique. Nous en sommes loin !
M. Sylvain Picard . - L'objectif de la générication est de fournir un médicament qui aura les mêmes effets, dans le sang de l'individu qui le consommera, que le princeps. Il me semble atteint, mais il ne faut pas attendre de plus-value en termes d'efficacité thérapeutique.
Par ailleurs, l'industrie française du médicament repose depuis la fin de la Seconde Guerre mondiale sur la chimie, et elle approche aujourd'hui de ses limites. Les « me too » en sont le parfait exemple : au sein d'une même classe thérapeutique, les molécules sont modifiées à la marge tandis que les prétendus effets nouveaux de ces médicaments ne se confirment pas avec le temps. Il faut entrer dans une nouvelle ère et dépasser la chimie ; je pense notamment aux biothérapies dont le coût reste très élevé. Sans faire d'économies sur les médicaments chimiques, il ne sera pas possible de financer la recherche et la prise en charge par l'assurance maladie des nouvelles thérapeutiques. Les génériques ont donc un intérêt de santé publique qui va au-delà de la simple situation financière à court terme de la sécurité sociale. Ils doivent permettre de faire bénéficier les patients des véritables innovations thérapeutiques.
Mme Annie David . - J'avais bien compris le rôle qui est celui des médicaments génériques, mais les propos introductifs des intervenants me semblaient faire la part belle aux aspects économiques de cette question. Je vous remercie donc tous d'avoir, dans vos réponses, pris en compte les enjeux de santé publique. Je suis également tout à fait consciente de la nécessité de soutenir l'innovation médicale, mais la recherche dispose-t-elle de moyens suffisants ?
Les premières victimes des difficultés de notre système de protection sociale sont les patients qui font face, pour un nombre croissant d'entre eux, à un reste à charge de plus en plus important. Celui-ci n'est pas toujours lié au médicament, mais les déremboursements sont désormais fréquents. Pourtant, c'est la rémunération des pharmaciens ou des médecins, les profits des uns et des autres, qui sont les principaux sujets de préoccupation. Ceux-ci reposent en partie sur de l'argent public, les cotisations des salariés et des employeurs. Il ne faut donc jamais oublier, en matière de santé publique, l'attachement qui est le nôtre au système de protection sociale. Il doit être de qualité, afin que chacune et chacun puisse en bénéficier à hauteur de ses besoins.
M. Yves Daudigny, président . - Je tiens à remercier tous les intervenants pour leur participation à cette table ronde très instructive, dont nous publierons les résultats sous forme de rapport d'information.
* 1 Parmi les pays non européens, l'Inde représenterait environ 40 % de la production en valeur mais 22 % en volume, alors que la Chine connaîtrait une proportion inverse : 16 % de la production en valeur et 53 % en volume. En valeur, Israël et les Etats-Unis constituent les troisième et quatrième producteurs avec environ 10 % du marché chacun.
* 2 Par exemple commercialisée par Pfizer sous le nom Tahor en France.
* 3 Commercialisée en France par Astrazeneca sous le nom Crestor.
* 4 « Efficacité et efficience des hypolipémiants - Une analyse centrée sur les statines ».
* 5 Antibiotiques, antidiabétiques oraux, asthme et BPCO, hypocholestérolémiants dont statines, antihypertenseurs, antidépresseurs, anxiolytiques et antiulcéreux (IPP).
* 6 France, Italie, Espagne, Allemagne, Finlande, Norvège, Pays-Bas et Royaume-Uni.
* 7 Décision 07-D-09 du 14 mars 2007, puis arrêt de la Cour d'appel de Paris du 8 avril 2008 et arrêt de la Cour de cassation du 17 mars 2009.







