Rapport n° 34 (2009-2010) de Mme Marie-Thérèse HERMANGE , fait au nom de la commission des affaires sociales, déposé le 14 octobre 2009
Disponible au format Acrobat (772 Koctets)
Tableau comparatif au format Acrobat (356 Koctets)
-
AVANT-PROPOS
-
EXAMEN DES ARTICLES
-
Article 1er - (art. L. 1121-1 à
L. 1121-3, L. 1121-4, L. 1121-8-1 (nouveau), L. 1121-11,
L. 1121-12, L. 1121-14, L. 1121-15, L. 1121-16,
L. 1122-1-1 (nouveau), L. 1122-1-2, L. 1122-2, L. 1123-6,
L. 1123-89, L. 1125-2, L. 1125-3, L. 1126-3,
L. 1126-5, L. 1126-7, L. 1126-10 du code de la santé
publique) Création de trois catégories de recherches sur la
personne dans un cadre législatif unique
-
Article 2 - (art. L. 1121-16-1 du code
de la santé publique) - Définition des recherches
interventionnelles à finalité non commerciale
-
Article 3 - (art. L. 1123-7,
L. 1243-3 et L. 1243-4 du code de la santé publique) -
Simplification et mise en cohérence du régime d'autorisation et
de déclaration des recherches utilisant des collections
d'échantillons biologiques humains
-
Article 4 - (art. L. 1123-1 et
L. 1123-5 du code de la santé publique) - Statut juridique et
conditions de retrait d'agrément des comités de protection des
personnes
-
Article 4 bis (nouveau) - (art.
L. 5126-1 du code de la santé publique) -Distribution des produits,
substances ou médicaments nécessaires à la
recherche
-
Article 4 ter (nouveau) - (art.
L. 1125-3 du code de la santé publique) - Mise en cohérence
du code de la santé publique et du code de l'environnement
-
Article 4 quater (nouveau) - (art.
L. 5124-9 du code de la santé publique) - Régime des
médicaments radiopharmaceutiques et de certains médicament
élaborés dans le cadre de la recherche
-
Article 4 quinquies (nouveau) - (art. L.
1123-1-1 nouveau du code de la santé publique) - Création d'une
commission nationale des recherches impliquant la personne humaine
-
Article 4 sexies (nouveau) -
Possibilité de dérogation à la procédure de
contrôle du traitement de l'information
-
Article 4 septies - Interdiction du test
de la dose maximum tolérée pour un médicament sans lien
avec la pathologie de la personne à laquelle il est
administré
-
Article 5 - Entrée en vigueur de la
loi
-
Intitulé de la proposition de loi
-
Article 1er - (art. L. 1121-1 à
L. 1121-3, L. 1121-4, L. 1121-8-1 (nouveau), L. 1121-11,
L. 1121-12, L. 1121-14, L. 1121-15, L. 1121-16,
L. 1122-1-1 (nouveau), L. 1122-1-2, L. 1122-2, L. 1123-6,
L. 1123-89, L. 1125-2, L. 1125-3, L. 1126-3,
L. 1126-5, L. 1126-7, L. 1126-10 du code de la santé
publique) Création de trois catégories de recherches sur la
personne dans un cadre législatif unique
-
TRAVAUX DE LA COMMISSION
-
LISTE DES PERSONNES AUDITIONNÉES PAR LE
RAPPORTEUR
-
ANNEXE - PRÉSENTATION POWERPOINT DE
L'EXAMEN DE LA PROPOSITION DE LOI RELATIVE AUX RECHERCHES SUR LA
PERSONNE
N° 34
SÉNAT
SESSION ORDINAIRE DE 2009-2010
|
Enregistré à la Présidence du Sénat le 14 octobre 2009 |
RAPPORT
FAIT
au nom de la commission des affaires sociales (1) sur la proposition de loi , ADOPTÉE PAR L'ASSEMBLÉE NATIONALE, relative aux recherches sur la personne ,
Par Mme Marie-Thérèse HERMANGE,
Sénateur
|
(1) Cette commission est composée de : Mme Muguette Dini , présidente ; Mme Isabelle Debré, M. Gilbert Barbier, Mme Annie David, M. Gérard Dériot, Mmes Annie Jarraud-Vergnolle, Raymonde Le Texier, Catherine Procaccia, M. Jean-Marie Vanlerenberghe , vice-présidents ; MM. Nicolas About, François Autain, Paul Blanc, Jean-Marc Juilhard, Mmes Gisèle Printz, Patricia Schillinger , secrétaires ; M. Alain Vasselle, rapporteur général ; Mmes Jacqueline Alquier, Brigitte Bout, Claire-Lise Campion, MM. Jean-Pierre Cantegrit, Bernard Cazeau, Mme Jacqueline Chevé, M. Yves Daudigny, Mme Christiane Demontès, M. Jean Desessard, Mme Sylvie Desmarescaux, M. Guy Fischer, Mme Samia Ghali, MM. Bruno Gilles, Jacques Gillot, Adrien Giraud, Mme Colette Giudicelli, MM. Jean-Pierre Godefroy, Alain Gournac, Mmes Sylvie Goy-Chavent, Françoise Henneron, Marie-Thérèse Hermange, Gélita Hoarau, M. Claude Jeannerot, Mme Christiane Kammermann, MM. Marc Laménie, Serge Larcher, André Lardeux, Dominique Leclerc, Jacky Le Menn, Jean-François Mayet, Alain Milon, Mmes Isabelle Pasquet, Anne-Marie Payet, M. Louis Pinton, Mmes Janine Rozier, Michèle San Vicente-Baudrin, MM. René Teulade, François Vendasi, René Vestri, André Villiers. |
Voir le(s) numéro(s) :
|
Assemblée nationale ( 13 ème législ.) : |
1372 , 1377 et T.A. 229 |
|
|
Sénat : |
177 rect (2008-2009) et 35 (2009-2010) |
|
AVANT-PROPOS
Mesdames, Messieurs,
Le principe de l'inviolabilité de la vie humaine emporte une double conséquence : l'indisponibilité du corps humain et l'impossibilité d'autoriser autrui à porter atteinte à sa vie 1 ( * ) . En conséquence, tout acte de recherche médicale non directement destiné à soigner un malade était considéré avant la « loi Huriet-Sérusclat » du 20 décembre 1988 2 ( * ) , comme illicite et susceptible d'entraîner, pour le chercheur, une condamnation pour coups et blessures ou administration de substances nuisibles.
Or, dans le même temps, la sécurité des personnes imposait de subordonner la mise sur le marché d'un médicament à un examen préalable scientifique approfondi, impliquant nécessairement des essais sur l'homme.
Cette exigence est consacrée de longue date par le droit européen. La convention du 22 juillet 1964 relative à l'élaboration d'une pharmacopée européenne, élaborée sous l'égide du Conseil de l'Europe, a en effet marqué l'amorce du rapprochement des législations nationales sur le médicament afin de parvenir à un même degré de rigueur et donc de qualité. Parallèlement, des normes de droit communautaire ont été élaborées afin de garantir une distribution du médicament conforme aux règles du marché commun. La directive du 26 janvier 1965 et surtout celle du 20 mai 1975, qui l'a complétée et amplifiée, ont imposé des essais cliniques sur des volontaire sains (essais dits de phase I destinés à déterminer les effets d'un médicament sur l'organisme humain ainsi que ses éventuels effets nocifs), dans le cadre des procédures européennes d'autorisations de mise sur le marché (AMM) 3 ( * ) . Un contrôle renforcé a dès lors été mis en oeuvre pour assurer la conformité au cadre légal international des AMM des médicaments en France, grâce à la création de la commission d'autorisation de mise sur le marché des médicaments créée en 1978 4 ( * ) .
La contradiction légale entre l'obligation scientifique - et européenne - de mener des essais et l'interdiction pénale de porter atteinte à la vie humaine n'en était pas pour autant levée. Il en résultait un frein à la recherche et des pratiques peu compatibles avec le droit des personnes qui, dans les faits, étaient rarement informées de leur participation à un essai, élaboré sans regard extérieur et dans le cadre de responsabilités mal définies entre le médecin en charge de la recherche et la société pharmaceutique commanditaire.
Dix ans après l'introduction en droit français de l'AMM du médicament, la loi Huriet-Sérusclat a trouvé un équilibre entre les nécessités de la recherche tournée vers l'intérêt collectif et l'inviolabilité de la vie humaine, entre la protection des chercheurs et celle des personnes. Le régime de responsabilité a tout d'abord été clarifié en obligeant le promoteur public ou privé de la recherche à présenter les demandes d'autorisation des protocoles qui seront effectués pour son compte par le chercheur responsable, dit investigateur, et son équipe. La recherche envisagée est également, depuis cette date, systématiquement soumise à un examen effectué par les comités consultatifs de protection des personnes dans la recherche biomédicale. Leur avis, consultatif, a été transformé en autorisation préalable par la loi du 9 août 2004 relative à la politique de santé publique 5 ( * ) et leur nom a été modifié en comités de protection des personnes.
|
Les comités de protection des personnes Les « comités consultatifs de protection des personnes dans la recherche biomédicale » (CCPPRB), créés par la loi Huriet-Sérusclat du 20 décembre 1988, sont devenus les « comités de protection des personnes » en application de la loi du 9 août 2004. Il existe en France quarante comités de protection des personnes chargés de se prononcer sur la conformité aux exigences de la protection des personnes de chaque protocole de recherche biomédicale sur l'être humain. Sans un avis favorable de leur part, aucune recherche ne peut être engagée. L'article L. 1123-7 du code de la santé publique présente une liste non limitative de critères au regard desquels les comités se prononcent sur la validité d'un protocole de recherche. Parmi ceux-ci figurent l'information fournie aux personnes sollicitées ainsi que les montants et modalités d'indemnisation des participants lorsque la recherche y donne droit. Les comités sont composés à parité de deux collèges, l'un de scientifiques et l'autre de membres de la société civile, tous choisis pour leur compétence. La compétence de chacun des quatorze membres titulaires (et d'autant de membres suppléants) est précisée par l'article R. 1123-4 du code de la santé publique. Il dispose : Les comités de protection des personnes comprennent quatorze membres titulaires répartis en deux collèges : Le premier collège est composé de : 1° Quatre personnes ayant une qualification et une expérience approfondie en matière de recherche biomédicale, dont au moins deux médecins et une personne qualifiée en raison de sa compétence en matière de biostatistique ou d'épidémiologie ; 2° Un médecin généraliste ; 3° Un pharmacien hospitalier ; 4° Un infirmier ; Le deuxième collège est composé de : 1° Une personne qualifiée en raison de sa compétence à l'égard des questions d'éthique ; 2° Un psychologue ; 3° Un travailleur social ; 4° Deux personnes qualifiées en raison de leur compétence en matière juridique ; 5° Deux représentants des associations agréées de malades et d'usagers du système de santé. Des membres suppléants en nombre égal au nombre de membres titulaires sont désignés pour chaque catégorie dans les mêmes conditions.
Ils sont nommés par le préfet de région
après appel à candidature pour un mandat de trois ans
renouvelable.
|
La proposition de loi soumise à l'examen du Sénat propose une nouvelle variation du dispositif avec l'objectif d' unifier les différents types de recherches médicales au sein d'un cadre commun de contrôle . Pareille évolution ne va pas de soi. En effet, elle expose au risque de sacrifier la détermination de principes intangibles aux pressions liées à l'innovation scientifique. De ce point de vue, le fait que la loi fondatrice Huriet-Sérusclat ait été modifiée déjà à sept reprises 6 ( * ) en l'espace de vingt ans, sans qu'aient été pour autant pleinement prises en compte les recommandations faites par le sénateur Huriet lui-même en 2001 7 ( * ) , incite à la prudence. Dans un domaine aussi sensible que la recherche médicale, il est en effet crucial que les acteurs disposent du temps nécessaire pour s'approprier les normes d'encadrement, sans quoi celles-ci ne peuvent être pleinement efficaces. Chaque modification législative entraîne, de plus, l'adoption de multiples textes réglementaires d'importance variable mais auxquels doivent se conformer tant les acteurs de la recherche que les organismes en charge du contrôle, ce qui suscite inévitablement des effets de retard et d'empilement.
A l'inverse, affirmer des principes sans tenir compte de la réalité, ce qui les rend de facto inapplicables, pourrait susciter le retour de pratiques clandestines auxquelles la loi cherche précisément à mettre fin. Ainsi, dès l'origine, la classification des différents types de recherches s'est avérée difficile et a dû évoluer : la distinction entre les recherches « avec » ou « sans » bénéfice individuel direct s'est révélée trop complexe en pratique et a été remplacée par une distinction a priori plus large entre « recherches biomédicales » et « recherches en soins courants » par la loi du 9 août 2004.
Il apparaît aujourd'hui que cette nouvelle répartition, pourtant précisée par décret 8 ( * ) , n'a pas pu s'imposer dans les faits. Or, une définition opérationnelle de la recherche doit figurer dans la loi pour permettre la protection effective des personnes sans nuire au développement de la recherche.
Au-delà de cette confrontation aux faits, les évolutions législatives sont également la conséquence de ce que, pionnière en matière d'éthique médicale, la loi Huriet-Sérusclat a vu son champ d'action étendu à une part de plus en plus importante de la recherche médicale au fur et à mesure que l'intérêt des solutions qu'elle a proposées s'est imposé : l'importance grandissante des comités de protection des personnes en est l'illustration.
I. UNE MEILLEURE PRISE EN COMPTE DE LA RECHERCHE
Dans l'acception générale du terme, la recherche scientifique est un travail intellectuel « ayant pour objet la découverte, l'invention, la progression des connaissances nouvelles » 9 ( * ) . En droit, l'article L. 1121-1 du code de la santé publique vise les recherches « organisées et pratiquées sur l'être humain en vue du développement des connaissances biologiques ou médicales » , l'article L. 1121-2 leur assigne comme objectif « la connaissance scientifique de l'être humain et les moyens susceptibles d'améliorer sa condition » . En outre, élaborée sous l'égide de l'Association médicale mondiale et adoptée en juin 1964, la déclaration d'Helsinki sur les principes éthiques applicables à la recherche médicale impliquant des êtres humains définit précisément, dans son point 7, l'objectif premier de ce type de recherches comme étant « de comprendre les causes, le développement et les effets des maladies et d'améliorer les interventions préventives, diagnostiques et thérapeutiques (méthodes, procédures et traitements) » .
Il en résulte que le progrès de la prise en charge des malades passe nécessairement par la recherche tant clinique que non interventionnelle, qui constitue donc une priorité de santé publique mais qu'il convient de mener dans le respect des principes éthiques.
A. L'IMPORTANCE DES RECHERCHES CLINIQUE ET NON INTERVENTIONNELLE
Votre rapporteur a déjà eu l'occasion de souligner combien recherche fondamentale et recherche clinique sont complémentaires et indissociables 10 ( * ) . Force est cependant de reconnaître que l'évolution thérapeutique a été principalement conduite, au cours des trente dernières années, par « des améliorations continuelles des molécules utilisées et de leur mode d'administration » 11 ( * ) , plus que par la découverte de nouvelles molécules ou de nouvelles formes de thérapie. La recherche clinique est donc la plus immédiatement porteuse d'espoir et de bien-être collectif.
Destinée à permettre l'amélioration de la santé du plus grand nombre, elle conditionne aussi la reconnaissance de l'excellence scientifique des chercheurs français. La mobilisation du potentiel de recherche de notre pays suppose de favoriser tant l'éclosion que la réalisation de leurs projets. En effet, dans un contexte de concurrence scientifique aigüe et à cadre légal constant, c'est de la qualité de la recherche que dépend en large partie la décision d'implantation des protocoles de recherche internationaux conduits par les laboratoires pharmaceutiques.
1. Faciliter la recherche par les promoteurs institutionnels
La recherche destinée à une découverte brevetable, ou y aboutissant car il est impossible de préjuger de son résultat, est la moins difficile à engager et à financer. Les laboratoires pharmaceutiques sont promoteurs de leurs propres recherches et s'associent à des organismes publics pour conduire celles qui leur paraissent intéressantes. Ils peuvent également, une fois une recherche publique menée, prendre en charge le développement des résultats ou faire l'acquisition des brevets.
A l'inverse, les recherches qui ne présentent aucun intérêt commercial immédiat doivent être promues par l'Etat. Elles sont conduites par les promoteurs institutionnels qui sont ainsi définis par l'Afssaps 12 ( * ) :
« On entend par promoteur « institutionnel », toute personne physique ou morale qui prend l'initiative d'une recherche biomédicale [et] ne poursuivant pas un but lucratif. »
En France, il peut s'agir d'un organisme public de recherche, d'une université, d'un établissement public de santé ou d'un établissement de santé privé d'intérêt collectif, d'un établissement public ou de toute autre personne physique ou morale ne poursuivant pas un but lucratif. On parle également de promoteur " non commercial " ou " académique ".
Deux conditions sont nécessaires à la reconnaissance du statut de promoteur institutionnel qui entraîne une taxation moindre de la recherche conduite :
- le propriétaire des données de l'essai clinique est l'organisme ;
- il n'y a pas, au moment de la demande d'autorisation d'un essai clinique, d'engagement entre le promoteur et un tiers l'autorisant à utiliser ces données pour des objectifs de commercialisation.
Un comité national de coordination de la recherche adossé à la fédération hospitalière de France s'assure ainsi de la cohérence des projets menés par les différents centres hospitaliers et universitaires ainsi que du « continuum (recherche fondamentale - recherche clinique) de la recherche biomédicale et en santé » 13 ( * ) . L'un des exemples les plus importants est celui de l'assistance publique des hôpitaux de Paris, AP-HP, promoteur institutionnel de plus de six cents protocoles par an.
C'est presque exclusivement dans le cadre des essais portés par des promoteurs institutionnels que peuvent s'opérer les essais comparatifs entre médicaments ou entre dispositifs médicaux, dont votre commission a eu l'occasion de souligner l'utilité 14 ( * ) et qui ne sont pas obligatoires dans le cadre des demandes d'autorisation de mise sur le marché.
La recherche menée par les promoteurs institutionnels est porteuse de bénéfices thérapeutiques et économiques réels, liés à une meilleure prise en charge des patients. Elle peut justifier un régime légal plus souple dès lors que l'on parviendra à distinguer les différentes catégories de recherches, ce qui n'est pas chose aisée.
2. Une extension nécessaire du champ de la recherche ?
La distinction entre les différentes catégories de recherches médicales n'est pas évidente. En témoigne la forte attractivité du régime mis en place par la loi Huriet-Sérusclat pour les recherches biomédicales. Dans un premier temps, certains comités de protection des personnes, partisans d'une interprétation large des dispositions « y incluaient également les études purement scientifiques et sans finalité diagnostique ou thérapeutique directe à l'égard du patient telles que les recherches en physiologie du sport, en ergonomie, en diététique, en cosmétologie, les essais en milieu sous-marin ou en apesanteur » 15 ( * ) . C'est pour limiter le champ d'application de l'article L. 1121-1 du code que la loi de santé publique a remplacé les termes « essais ou expérimentation » par celui, jugé plus précis, de « recherche » . Néanmoins, la nécessité de prendre en compte l'ensemble des recherches médicales, alors même que le droit communautaire ne s'intéresse qu'aux médicaments et dispositifs médicaux relevant d'une autorisation de mise sur le marché, a amené le législateur à tenter de définir quels types précis de recherches pouvaient bénéficier d'un régime juridique autonome par rapport à la recherche biomédicale.
La loi Huriet-Sérusclat avait posé une distinction entre les recherches « dont on attend un bénéfice thérapeutique direct pour la personne qui s'y prête » et les recherches « sans finalité thérapeutique directe » , le régime de ces dernières étant beaucoup plus contraignant en termes de risque ( « aucun risque sérieux prévisible » ) et de personnes susceptibles de participer aux essais. Cette distinction, fondée sur l'intérêt de la personne participant à la recherche, constituait un important progrès par rapport à la distinction historique entre recherche individuelle à finalité thérapeutique et recherche collective à finalité cognitive. Pourtant, en ne s'en séparant pas totalement, elle conduisait, selon le comité national consultatif d'éthique 16 ( * ) (CCNE), « à rendre floue la distinction entre recherche et soins » . Or, les deux démarches sont distinctes. Alors que le soin est fondé sur le dialogue entre médecin et patient, la recherche repose sur une démarche épistémologique tendant à la validation d'hypothèses. Comme le souligne le CCNE, l' «objectivation du malade dans la recherche expérimentale est un réquisit méthodologique » . Il est donc très dangereux, du point de vue éthique, de présenter la recherche comme une forme de soins renforcée, ainsi que certains promoteurs et investigateurs continuent à le faire. En effet, « ce fut précisément tout l'apport de la loi Huriet que d'avoir construit un cadre juridique spécifique qui autonomise la recherche au sein des pratiques médicales » 17 ( * ) . Pratiquement, la difficulté à conduire des recherches sans bénéfice thérapeutique direct et à appréhender la nature d'un tel bénéfice avait pu conduire à des classifications abusives d'activités de recherche en tant que recherches biomédicales : « au nom d'un prétendu bénéfice direct pour leur santé, on a pu exposer aux aléas de la recherche des individus vulnérables, bafouant l'intention initiale du législateur qui était de leur accorder une protection particulière » .
Pour remédier à cette difficulté, la loi de santé publique du 9 août 2004 a unifié le régime des recherches biomédicales, désormais appréciées selon un rapport bénéfice/risque, mais a décidé d'en exclure les « recherches visant à évaluer les soins courants, autres que celles portant sur les médicaments, lorsque tous les actes sont pratiqués et les produits utilisés de manière habituelle mais que des modalités particulières de surveillance » sont prévues 18 ( * ) . Ces modalités particulières de surveillance doivent figurer dans un protocole soumis à un comité de protection des personnes territorialement compétent appelé à se prononcer sur l'autorisation de la recherche 19 ( * ) . Mais la recherche en soins courants n'a eu que peu de succès sans doute à cause de sa « qualification hybride » 20 ( * ) . En effet, elle tend à simplifier les procédures nécessaires pour mener ce type de recherches sans l'affranchir totalement du système de contrôle mis en place par la loi sur les recherches biomédicales ni le définir exactement malgré les dispositions de l'article R. 1121-3 du code de la santé publique issues du décret n° 2006-477 du 26 avril 2006.
La détermination d'un régime spécifique dans lequel pourraient s'insérer les recherches des promoteurs institutionnels ne concernant pas la mise sur le marché de médicaments ou dispositifs médicaux n'a donc pas été possible jusqu'à aujourd'hui, faute d'un critère de distinction entre soins et recherche juridiquement solide et éthiquement fondé.
Par ailleurs, depuis la loi de santé publique du 9 août 2004, sont exclues de l'application des dispositions relatives aux recherches biomédicales les « recherches dans lesquelles tous les actes sont pratiqués et les produits utilisés de manière habituelle, sans aucune procédure supplémentaire ou inhabituelle de diagnostic ou de surveillance » 21 ( * ) . Ces recherches sont qualifiées de « non interventionnelles » par l'article R. 1121-2 du code de la santé publique issu du décret du 26 avril 2006 précité. Il s'agit en fait des études de données, épidémiologiques par exemple, ne nécessitant aucun acte supplémentaire par rapport à la prise en charge thérapeutique dont bénéficie le patient mais reposant sur la collecte et l'exploitation des données médicales. Cette distinction rejoint celle faite par l'Association médicale mondiale, créée en 1947 et à l'origine de la déclaration d'Helsinki : la deuxième édition de son manuel d'éthique médicale, paru en 2009, sépare ainsi la recherche médicale destinée à mieux comprendre la physiologie humaine et la recherche médicale non physiologique, au sein de laquelle figurent les recherches épidémiologiques ainsi que les recherches sur les systèmes de santé.
En dehors des recherches biomédicales dont le régime légal, appuyé sur le droit communautaire, est stabilisé depuis 1988, le droit applicable aux autres types de recherche médicale est donc encore en quête d'une cohérence qui garantisse sa sécurité et son caractère éthique.
L'évolution de la recherche est indissolublement liée, depuis la fin de la Seconde Guerre mondiale, au développement de l'éthique. Quelles que soient les évolutions législatives, le plus haut niveau de protection pour les personnes participant à la recherche doit être garanti.
B. LA PRÉSERVATION DES PRINCIPES ÉTHIQUES
L'acte fondateur de l'éthique moderne de la recherche médicale est le code de Nuremberg, qui reprend les dix principes impératifs en matière de recherche sur les personnes exposés par les magistrats du tribunal international chargé de juger les médecins nazis coupables d'expérimentations criminelles. Ces principes peuvent être regroupés autour de deux exigences principales : la liberté du consentement des personnes appelées à participer à la recherche et l'intérêt scientifique de celle-ci.
En France, ce sont les comités consultatifs de protection des personnes dans la recherche biomédicale (CCPPRB) créés par la loi Huriet-Sérusclat qui ont permis une mise en oeuvre rigoureuse et systématique de ces principes, auparavant laissés largement à l'appréciation informée, mais subjective, des chercheurs et aux appréciations divergentes des différents comités d'éthique mis en place à partir des années soixante-dix. Le rôle des CCPPRB s'est accru avec l'évolution des textes, en même temps qu'étaient envisagés des aménagements aux procédures de recueil du consentement des participants à la recherche.
1. Le rôle des comités de protection des personnes
Le champ d'action des CCPPRB mis en place en 1988 a été considérablement élargi par la loi de santé publique, qui a conditionné l'autorisation d'une recherche biomédicale au recueil de leur avis favorable 22 ( * ) . Cette extension répond aux exigences contemporaines en matière de recherche. Ceci étant, poursuivre dans cette voie en leur confiant le contrôle de l'ensemble des recherches sur la personne n'est envisageable qu'après avoir remédié aux dysfonctionnements anciens dont souffrent ces structures.
a) Les garants de l'éthique de la recherche
Composition des comités
Il existe actuellement quarante CCP répartis sur sept « zones » : onze en Ile-de-France, quatre dans le Nord-Ouest, six dans l'Ouest, quatre dans l'Est, six dans le Sud-Est, cinq pour le Sud-Méditerranée et quatre pour le Sud-Ouest, les Antilles, la Guyane et la Réunion.
Ce choix géographique répond à plusieurs logiques. Un comité unique serait évidemment inadapté pour l'examen des milliers de dossiers de recherche déposés chaque année. Le nombre et la répartition des comités correspondent donc à la distribution de la recherche en France et à l'implantation des équipes :
- la proximité physique des comités et des équipes de recherche favorise la compréhension de la démarche scientifique et facilite la mise en oeuvre d'un processus de conformation aux exigences éthiques ;
- l'exigence selon laquelle doivent figurer parmi les membres titulaires de chaque comité « quatre personnes ayant une qualification et une expérience approfondie en matière de recherche biomédicale » 23 ( * ) implique de trouver des chercheurs volontaires pour consacrer le temps nécessaire à l'examen des dossiers. Concrètement, cela suppose que les comités puissent se réunir à proximité des lieux de travail de leurs membres, d'autant qu'il s'agit de structures indépendantes dont la constitution repose depuis l'origine sur le volontariat. Ainsi, un groupe de personnes réunissant les conditions légales et réglementaires pour la composition d'un comité de protection des personnes peut se faire agréer comme tel pour une durée de six ans par le ministre de la santé. La qualité des comités dépendant de celle de leurs membres, il convient de permettre aux plus qualifiés, et non seulement aux plus volontaires, d'y siéger. A défaut, le risque est réel de voir disparaître des comités, comme c'est déjà le cas pour huit d'entre eux depuis 2005.
Conformément à la règle en matière d'éthique, les délibérations des comités sont collégiales, la détermination de la hiérarchie des valeurs applicables résultant de la confrontation des points de vue. Or, l'une des caractéristiques des comités tient singulièrement à leur composition paritaire : les quatorze titulaires sont répartis en deux collèges de sept membres, l'un scientifique et l'autre issu de la société civile 24 ( * ) . Les critères de recrutement extrêmement précis fixés par le code de la santé publique visent à permettre l'expression d'approches scientifiques, méthodologiques, juridiques, éthiques et de faire entendre la voix des patients. La parité de la formation des comités a été critiquée au nom du manque de connaissances scientifiques des membres issus de la société civile. Il s'agit en fait d'un avantage. Non seulement les CCPP n'ont pas vocation à être des comités d'experts, mais c'est précisément la nécessité d'une pédagogie de la part des membres qualifiés en matière de recherche qui fait naître le dialogue et permet la prise de décisions éclairées et éthiquement fondées. On peut craindre que si le collège scientifique devenait majoritaire, l'effort de pédagogie s'amoindrirait.
Rôle des comités
D'abord essentiellement chargés du contrôle des conditions du consentement donné à la participation à la recherche, les comités ont ensuite eu compétence en matière de contrôle de la qualité scientifique des recherches envisagées. Deux conditions doivent être remplies pour qu'une recherche puisse être autorisée :
- conformément au principe du code de Nuremberg selon lequel seule une recherche nécessaire est légitime, la recherche proposée doit intégrer les dernières connaissances acquises dans le domaine envisagé ;
- le protocole proposé doit prévoir répondre à la question posée, ce qui explique la présence, parmi les membres sans lesquels une délibération ne saurait être valable, d'un méthodologiste. Ici encore, on pourrait penser que les protocoles proposés par des chercheurs reconnus ou des promoteurs privés seraient exempts de défauts de méthode. La pratique prouve qu'il n'en est rien et que le rôle des comités est de ce point vue également essentiel.
Le contrepoids nécessaire à l'obligation d'obtenir l'avis positif d'un comité pour pouvoir engager une recherche a été la mise en place d'une procédure d'appel . A la suite de l'avis négatif d'un comité, il peut être demandé au ministre de la santé d'en désigner un autre qui examinera à nouveau le dossier. La région dans laquelle le dossier sera étudié pour la seconde fois est alors tirée au sort puis un comité est choisi en son sein en raison de ses compétences reconnues. Cette procédure n'est toutefois pas sans poser de problèmes : la présente proposition de loi ouvre la possibilité d'y remédier.
Comme le soulignait Claude Huriet dans son rapport sur le fonctionnement des CCPPRB 25 ( * ) , les comités sont « la pierre angulaire » du dispositif d'éthique de la recherche en France. La qualité de leurs membres, essentiellement bénévoles, et des décisions rendues ne peut que susciter l'admiration. De nombreux dysfonctionnements pourtant anciens n'ont toutefois toujours pas pu être corrigés.
b) Un fonctionnement perfectible
Deux rapports, celui de Claude Huriet en 2001 et celui de l'inspection générale des affaires sociales de juillet 2005 26 ( * ) , ont analysé le fonctionnement et les fragilités des comités. Celles-ci découlent de leur indépendance et de leur statut.
Organismes nécessairement indépendants pour garantir l'objectivité et la reconnaissance internationale de leurs décisions, les comités courent tout d'abord le risque de développer des pratiques divergentes en matière d'appréciation des dossiers soumis . Ceci serait doublement préjudiciable : les garanties éthiques se trouveraient affaiblies par l'édiction d'exigences différentes et aléatoires ; il est en outre à craindre que les promoteurs ne soient tentés de déposer leurs dossiers devant les comités jugés les plus accommodants.
De ce point de vue, la grande disparité dans le nombre de dossiers traités entre les différentes régions, relevé par l'Igas à partir des statistiques de 2003, ne peut que susciter l'inquiétude. A cette date, trois groupes de comités pouvaient être dégagés :
- ceux examinant plus de cent dossiers nouveaux par an (au premier rang desquels les comités d'Ile-de-France qui examinaient 29 % de l'ensemble des nouveaux dossiers, suivis par les comités de la région Rhône-Alpes avec 11 %) ;
- ceux examinant moins de cent dossiers par an ;
- ceux examinant moins de vingt dossiers par an.
A l'une des extrémités du spectre, on peut légitimement redouter que les comités saisis du plus petit nombre de dossiers ne soient pas en situation de développer une expertise suffisante en matière de délibération ; mais à l'autre extrémité, et quelle que soit l'efficacité des procédures d'examen mises en place, le traitement de trop nombreux dossiers ne peut se faire qu'au détriment de l'approfondissement de l'analyse et de la délibération. Un phénomène d'entropie n'est pas à exclure, dans lequel les comités les plus efficaces se verraient confier par les promoteurs un plus grand nombre de dossiers, ce qui accélèrerait encore la rapidité de l'examen des dossiers individuels et porterait le risque d'une instrumentalisation. Le choix par le promoteur ou le principal investigateur du comité auquel il s'adressera dans sa région est dès lors problématique. Il est de ce point de vue regrettable que les dispositions réglementaires permettant au ministre de la santé de fixer un seuil maximum de dossiers nouveaux au-delà duquel ceux-ci doivent être réattribués n'aient jamais été mises en oeuvre.
L'autre source de fragilité des comités est liée à l' indétermination de leur statut . En effet, l'évaluation des pratiques des comités à partir d'un référentiel élaboré par la Haute Autorité de santé n'a pu encore être mise en oeuvre, faute de publication du document de référence. Celle-ci ne pourra avoir lieu qu'une fois le règlement intérieur des comités établi par la direction générale de la santé, laquelle se trouve dans l'impossibilité de mener cette opération à son terme tant que la nature juridique des comités n'est pas déterminée. Simples personnes morales de droit privé dans le cadre de la loi Huriet-Sérusclat, les comités semblent être devenus des personnes publiques sui generis . Il appartient au législateur de lever cette ambigüité néfaste au bon fonctionnement du système des comités.
Ainsi, les comités souffrent fondamentalement de l'isolement dans lequel ils sont appelés à travailler sur les divers sujets qui leur ont été confiés au fil du temps. Seule la mise en place d'une instance de coordination disposant de prérogatives de puissance publique et adaptée à la spécificité des comités de protection des personnes est susceptible de remédier à des fragilités connues et remédiables.
Cependant, en amont du fonctionnement des comités, ce sont les règles encadrant le consentement des personnes à participer aux recherches cliniques qui doivent être garanties.
2. Le consentement
Les conditions d'une réelle liberté de choix en matière de participation à une recherche biomédicale sont de nature tout autant philosophique et éthique que juridique. Le socle d'une décision libre en la matière est de ne pas attendre de bénéfice thérapeutique du protocole dans lequel on décide de s'engager. La recherche est pour l'individu non pas une promesse, ni même un espoir, de guérison, mais un risque qu'il accepte de prendre, non pas pour lui-même mais pour la collectivité. Même si le législateur a affirmé dès l'origine que, dans le cadre de la recherche, l'intérêt de la personne prime sur celui de la science et de la collectivité 27 ( * ) , ce qui empêche l'instrumentalisation de la personne, l'objectivisation du patient est, nous l'avons vu, consubstantielle à la démarche de recherche. Consentir à une recherche scientifique est d'abord une démarche altruiste et doit être vu et présenté comme tel.
a) Information et consentement
Le code de Nuremberg ne s'est pas contenté d'édicter l'obligation d'un consentement libre pour la participation à la recherche. Il a également imposé que ce consentement soit éclairé . Ceci pose la question de l'information donnée aux personnes susceptibles d'entrer dans un protocole de recherche. La loi Huriet-Sérusclat préfigure de ce point de vue la loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé. En effet, le contrôle de l'information et de son caractère complet figure depuis l'origine dans les attributions des comités de protection. Le calcul bénéfice/risque qui détermine l'intérêt d'une recherche structure également les notices d'information données aux patients. L'analyse de la présentation des informations et de leur exactitude est une part essentielle du travail des comités et celle qui, malgré les apparences, est la plus complexe, tant elle impose de se placer dans la situation de la personne susceptible de donner son consentement. Le contrôle a priori de l'information, et donc de la liberté du choix opéré, n'admet pas de solution simple. Une notice particulièrement exhaustive sur tous les aspects de la recherche menée peut, par sa longueur même, offrir moins d'assistance qu'une notice brève et pédagogique. Seule l'expérience des comités de protection des personnes permet de guider les promoteurs et investigateurs et d'éclairer les personnes.
Une fois l'information donnée, le consentement doit être recueilli sans ambiguïté. Si les formes à respecter sont relativement simples pour les personnes jouissant de toutes leurs facultés, le consentement des personnes fragiles a toujours appelé la plus grande vigilance du législateur et donc des comités de protection des personnes, le cas des recherches sur les enfants étant particulièrement exemplaire.
b) Les recherches sur les enfants
Les recherches faites spécifiquement pour déterminer les modalités thérapeutiques optimales de prescriptions de médicaments et de dispositifs médicaux aux enfants ont été encouragées par les pouvoirs publics. En effet, la simple adaptation d'un dosage destiné à des patients adultes au poids des enfants susceptibles de bénéficier des médicaments produit des résultats sensiblement moins efficaces, sur le plan thérapeutique, qu'un dosage spécifique, ce qui suppose un nouveau protocole de recherche. Ceux-ci ont été désormais imposés avant toute autorisation de mise sur le marché.
Cependant, pour les enfants comme pour toute personne fragile, les contraintes de recueil du consentement risquent d'introduire un biais en matière de sélection des personnes participant à l'étude. L'obligation de recueillir le consentement des deux parents restreint, de fait, le nombre d'enfants issus de familles monoparentales susceptibles de participer aux recherches. Outre le bénéfice éventuel dont ils sont ainsi privés, le risque est que les résultats de l'étude ne se trouvent, d'une manière ou d'une autre, faussés. Il faudrait donc adapter, de manière limitée, les modalités de recueil du consentement, ce qui pose d'importants problèmes éthiques.
II. LES DISPOSITIONS PROPOSÉES
La proposition de loi déposée par le député Olivier Jardé a été examinée puis adoptée par l'Assemblée nationale dans des délais très courts. On peut néanmoins dire d'elle, comme de la loi Huriet-Sérusclat adoptée définitivement en l'espace de deux mois, qu'elle s'appuie sur une réflexion approfondie et presque aussi ancienne que la loi de 1988 elle-même. Il s'agit en effet d'unifier le régime de contrôle éthique exercé sur la recherche médicale et de circonscrire le champ d'application de la loi Huriet-Sérusclat afin de faciliter le développement des autres types de recherches, non prises en compte par le droit européen.
Notons tout d'abord qu'il n'appartient pas au législateur, et plus précisément à la commission des affaires sociales du Sénat, de revenir sur les principes éthiques encadrant la recherche biomédicale depuis vingt ans, quel que puisse être l'intérêt du développement de la recherche médicale en France. Il n'est pas davantage question de déséquilibrer le fonctionnement du système existant, au risque de lui faire perdre son rôle progressivement affirmé de contrôle et d'amélioration de la qualité éthique et méthodologique de la recherche. De ce point de vue, le processus de mise en cohérence amorcé ne peut être isolé du cadre législatif de l'éthique en France et des contraintes communautaires. Concrètement, il ne peut trouver son plein aboutissement que dans le cadre de la révision des lois de bioéthique et devra sans doute être rapidement révisé en fonction de la prochaine directive européenne sur le médicament.
Pour autant, examiner dès à présent les dispositions de cette proposition de loi conserve toute sa pertinence, l'instauration d'un système de contrôle unifié sur la recherche présentant un intérêt éthique réel, à condition de le rééquilibrer pour permettre l'exercice effectif du contrôle par les comités de protection des personnes.
A. UN CONTRÔLE UNIFIÉ SUR LA RECHERCHE
La proposition de loi s'appuie sur l'expérience acquise au travers des tâtonnements législatifs des vingt dernières années pour envisager un régime de contrôle unifié de la recherche médicale. Que cette évolution, qui semble d'abord éthique, soit considérée comme le moyen de simplifier la recherche non encadrée par la loi Huriet-Sérusclat peut paraître étonnant. Il n'en demeure pas moins que le régime mis en place en 1988 s'est avéré particulièrement attractif en termes de reconnaissance internationale des recherches menées après autorisation des comités de protection des personnes. La publication, étape finale d'un processus de recherche, n'est en effet possible dans les grandes revues internationales que si un comité d'éthique indépendant en a validé la démarche. En outre, le contrôle confié aux comités de protection des personnes pourrait permettre d'alléger les procédures exigées par ailleurs.
1. Classifier la recherche en fonction des risques encourus
Le texte soumis à l'examen du Sénat propose tout d'abord de remplacer le système actuel de classification des recherches selon le double critère de leur objet - « amélioration des connaissances biologiques ou médicales » ou « amélioration des soins courants » - et de leur degré de contrainte - recherche nécessitant l'entrée des personnes dans un protocole spécifique ou fondée sur l'analyse des données issues des soins courants - par un système unifié .
Celui-ci reposerait sur le risque auquel sont exposés les participants et sur la distinction internationalement reconnue entre recherche interventionnelle et recherche observationnelle . Au triptyque « recherches biomédicales », « recherche en soins courants », « recherche sans procédure inhabituelle » qui figure, depuis la loi de santé publique de 2004, à l'article L. 1121-1 du code de la santé publique, se substituerait donc une gradation, du plus au moins risqué, comprenant les « recherches interventionnelles » , les « recherches interventionnelles présentant un risque négligeable » et les « recherches observationnelles » . Ces trois types de recherche relèveraient de régimes juridiques distincts, selon un degré de contrainte proportionné au risque dont ils sont porteurs.
Ceci étant, ils demeureraient tous soumis aux comités de protection des personnes chargés de les autoriser. Ce contrôle, désormais obligatoire pour tous les types de recherches médicales, permettrait la requalification, par les comités, des recherches présentées de façon erronée au titre d'un régime dans un autre, plus ou moins contraignant selon le cas. Le dispositif proposé a pour objectif d'accroître la transparence de la recherche médicale dans son ensemble et ainsi d'assurer un plus grand respect de l'éthique.
2. Simplifier les procédures
En clarifiant l'articulation des différents types de recherches médicales, la proposition de loi entend également simplifier les procédures auxquelles doivent se soumettre les chercheurs. En effet, la multiplication des instances d'autorisation et des contrôles préalables pénalise la recherche en raison des délais encourus par les projets, voire de l'abandon de ceux-ci par découragement des chercheurs. Dans la majorité des cas, ce ne sont pas les projets les plus risqués et présentant un intérêt commercial qui sont ainsi abandonnés mais plutôt ceux, portés par les promoteurs institutionnels, dont on peut attendre une amélioration des connaissances et donc de la prise en charge des malades.
Des aménagements, notamment en matière de recueil du consentement des personnes, sont ainsi envisagés pour les recherches présentant le moins de risque. Conformément aux principes fixés depuis 1988 et aux exigences du droit communautaire, le régime juridique applicable aux médicaments et dispositifs médicaux n'est pas appelé à évoluer autrement que par son inscription dans le champ plus large de la recherche médicale, ce qui entraîne la modification de son nom qui, de « recherche biomédicale », deviendrait « recherche interventionnelle ».
Il convient toutefois de souligner que les simplifications envisagées restent au moins partiellement hypothétiques. Ainsi, la proposition de loi n'envisage aucune modification de la loi de 1978 relative à l'informatique, aux fichiers et aux libertés 28 ( * ) qui encadre les recherches dites observationnelles. Or, son article 54 dispose que pour chaque demande de mise en oeuvre d'un traitement de données ayant pour fin la recherche dans le domaine de la santé, et préalablement à la saisine de la commission nationale de l'informatique et des libertés (Cnil), le comité consultatif sur le traitement de l'information en matière de recherche dans le domaine de la santé (CCTIRS) doit émettre un avis sur la méthodologie de la recherche, la nécessité du recours à des données nominatives à caractère personnel et la pertinence de ces données par rapport à l'objectif de la recherche. Pionnière au moment de son édiction, cette obligation a fait l'objet de nombreuses critiques en raison de son caractère jugé parfois redondant et des délais encourus. Plusieurs solutions ont ainsi pu être envisagées, de la mise en place d'une procédure d'instruction simplifiée au transfert de la compétence du CCTIRS aux comités de protection des personnes. Aucune de ces solutions ne paraît pouvoir être facilement mise en oeuvre.
*
Si l'on admet la nécessité d'établir un cadre de contrôle éthique unifié et d'alléger certaines procédures, il demeure que le caractère opérationnel et éthique de la réforme proposée dépendra des conditions de sa mise en oeuvre. Dans cette perspective, il apparaît que le texte doit être rééquilibré afin de permettre un fonctionnement pleinement efficace des comités de protection des personnes. Ceci suppose notamment la clarification des notions utilisées.
B. UN RÉÉQUILIBRAGE NÉCESSAIRE
Dans sa version actuelle, il est à craindre que, notamment, la proposition de loi accentue la situation d'isolement des comités de protection des personnes, ce qui est porteur de dérives susceptibles de nuire à l'éthique et à l'objectif d'instaurer un contrôle unifié sur l'ensemble de la recherche médicale.
1. Garantir le bon fonctionnement des comités de protection des personnes
Tout l'intérêt pratique de la réforme proposée dépendra de la qualité du travail de contrôle effectué par les comités de protection des personnes. Les améliorations attendues en matière de transparence et d'éthique ne pourront être réelles que si l'augmentation du nombre de dossiers soumis aux comités ne se traduit pas par un examen moins attentif.
Dès lors, il convient de remédier aux dysfonctionnements qui entravent l'action des comités. Ceci passe par une clarification de leur statut et une unification de la jurisprudence qui pourraient être assurées par une autorité administrative indépendante regroupant les comités et chargée d'accompagner leur action . Cependant, la création d'une structure nouvelle risque d'accroître encore le nombre d'acteurs au sein du système d'agences existant dans le domaine de la santé, dont la rationalisation est régulièrement souhaitée. On pourrait ensuite envisager le rattachement à une autorité administrative existante mais cette solution n'est pas d'une mise en oeuvre aisée. En effet, l'indépendance des comités par rapport à l'Afssaps - chargée de l'autorisation des essais - est nécessaire à la reconnaissance internationale de leur action. Le rapprochement qui semblerait le plus cohérent est donc impossible. Une autre solution pourrait consister à rattacher la structure de coordination des comités à l'autorité administrative indépendante du secteur de la santé incontestable qu'est la Haute Autorité de santé (HAS). Certes, le champ d'intervention de celle-ci est assez éloigné de son action mais elle serait capable de lui fournir l'appui logistique nécessaire.
Ce faisant, on néglige une dernière option qui aurait pu consister à placer les comités sous la tutelle d'un organisme rattaché à la direction générale de la santé mais cette solution risquait d'être insuffisamment opérationnelle étant donné la faiblesse des moyens de celle-ci, faiblesse régulièrement dénoncée comme la cause de son implication limitée dans le fonctionnement des comités 29 ( * ) .
2. Clarifier les définitions proposées
Une clarification des notions utilisées par la proposition de loi est également nécessaire. L'incertitude des termes fait peser sur la jurisprudence la charge de la définition, particulièrement délicate en matière d'éthique. Ainsi, bien que figurant dans les textes depuis 2004, la notion de « risque négligeable » n'a jamais été précisément définie. Etant donné son importance croissante, il appartient au législateur de ne laisser subsister aucune ambiguïté.
La France doit aussi tenir compte du cadre international dans lequel, depuis le code de Nuremberg d'août 1947, est définie l'éthique de la recherche clinique : les principes figurent dans la Convention d'Oviedo sur les droits de l'Homme et la biomédecine 30 ( * ) , élaborée sous l'égide du Conseil de l'Europe et que la France a signée le 4 avril 1997, ainsi que par son protocole additionnel, ouvert à la signature depuis le 25 janvier 2005 mais auquel elle n'a pas adhéré. Il paraît difficile que la France, même si ce dispositif ne s'applique pas dans l'ordre juridique interne, s'en écarte sensiblement, spécialement en matière de consentement des personnes, socle de l'éthique en matière de recherche.
*
Afin de permettre la mise en oeuvre d'un encadrement légal unifié de l'ensemble de la recherche médicale, objectif auquel elle souscrit, votre commission a adopté cette proposition de loi assortie de modifications susceptibles de donner plus de transparence à la recherche sur la personne et de renforcer la protection des personnes au sein du dispositif présenté .
EXAMEN DES ARTICLES
Article 1er - (art. L. 1121-1 à L. 1121-3, L. 1121-4, L. 1121-8-1 (nouveau), L. 1121-11, L. 1121-12, L. 1121-14, L. 1121-15, L. 1121-16, L. 1122-1-1 (nouveau), L. 1122-1-2, L. 1122-2, L. 1123-6, L. 1123-89, L. 1125-2, L. 1125-3, L. 1126-3, L. 1126-5, L. 1126-7, L. 1126-10 du code de la santé publique) Création de trois catégories de recherches sur la personne dans un cadre législatif unique
Objet : Cet article crée un cadre unique de contrôle pour l'ensemble des recherches sur la personne.
I - Le dispositif de la proposition de loi initiale
Le paragraphe I décrit les nouvelles catégories de recherche.
Le 1° modifie l'article L. 1121-1 du code de la santé publique. Il se divise en deux sous-parties.
Le a) inscrit le « développement de la recherche sur la personne » comme une priorité nationale. Cette expression est calquée sur celle de l'article L. 1231-1 A, relative au prélèvement et à la greffe d'organe. Des campagnes de sensibilisation sur l'importance de ces recherches pourraient ainsi être menées, vraisemblablement à des fins d'amélioration de leur image et pour encourager au volontariat.
Le b) présente les nouvelles catégories de recherches. La logique est inclusive alors que celle de l'actuel article L. 1121-1 procède par exclusion de ce qui n'est pas recherche biomédicale. Ces catégories peuvent être classées en deux groupes : les « recherches interventionnelles » décrites au 1° qui comportent « une intervention non justifiée par la prise en charge médicale habituelle de la personne » , et les « recherches non interventionnelles » figurant au 3° qui n'ajoutent aucune contrainte aux soins reçus par les malades dans le cadre de leur traitement. Au sein des recherches interventionnelles, une catégorie « ne comportant que des risques et contraintes négligeables » est distinguée au 2°.
La division entre recherche interventionnelle et non interventionnelle repose sur les moyens mis en oeuvre par la recherche et non sur la finalité de celle-ci, alors qu'auparavant les recherches biomédicales étaient définies comme « pratiquées sur l'être humain en vue du développement des connaissances biologiques ou médicales » . L'intervention se définit comme un ajout ou une soustraction aux soins et les différents types de recherche sont hiérarchisés selon le degré de contrainte qui pèsera sur les participants. Ainsi dans la recherche non interventionnelle, couramment dénommée observationnelle, la démarche de recherche n'interfère aucunement avec les soins. Cette définition, qui figure déjà dans l'article L. 1121-1, est issue des directives européennes.
La notion de risque négligeable mérite d'être examinée avec une attention particulière. Elle a été introduite par la loi de 2004 relative à la santé publique. Elle figure aux articles L. 1121-3 et L. 1121-11 du code de la santé publique pour justifier, à condition que la recherche soit sans influence sur la prise en charge médicale de la personne, une double dérogation :
- dans les cas où la recherche présente un risque négligeable, la personne en charge de la recherche n'est pas nécessairement un professionnel de santé ;
- un examen médical préalable n'est pas obligatoire.
Reprise pour caractériser une partie des recherches interventionnelles, cette notion est élargie par la proposition de loi. Le caractère négligeable porte en effet non seulement sur l'appréciation du risque mais également sur les contraintes imposées. La recherche peut donc avoir une influence sur la prise en charge médicale de la personne à condition qu'elle soit très faible.
Le c) étend à l'ensemble des recherches sur la personne l'obligation d'avoir un promoteur, obligation auparavant limitée aux seules recherches biomédicales. Il s'agit là de la généralisation d'un des apports les plus importants de la loi Huriet-Sérusclat, puisqu'aucune recherche ne peut être conduite sans être garantie juridiquement et financièrement par une personne, une entreprise ou une institution. Le chercheur est ainsi protégé contre tout aléa.
La mention actuellement présente dans la loi, selon laquelle le promoteur prend l'initiative d'une recherche, est supprimée. En effet, cette condition ne correspond pas à la réalité des faits et est largement formelle. L'imputation de la responsabilité de la recherche au promoteur, qu'elle permettait implicitement, est désormais expressément prévue par la proposition de loi.
Les d ) et e) alignent la terminologie française sur celle employée par les directives européennes relatives aux essais cliniques pour les chercheurs chefs d'équipes sur un site. Ceux d'entre eux qui sont responsables d'une équipe sont ainsi dénommés « investigateur principal », le titre de « coordonnateur » étant réservé au chercheur responsable de plusieurs sites.
Le 2° modifie l'article L. 1121-3 du code de la santé publique.
Le a) détermine les compétences nécessaires pour la conduite des différentes catégories de recherche. Le principe est que toute recherche interférant avec la prise en charge médicale de la personne doit être conduite par un médecin capable de gérer les risques liés à son intervention. Dès lors, ce n'est que si elle n'interfère pas avec la prise en charge médicale qu'une recherche interventionnelle ne présentant que des risques et contraintes négligeables peut être conduite par un professionnel de santé autre qu'un médecin. Il en est de même pour les recherches observationnelles. Le contrôle de l'adéquation entre les qualifications des chercheurs et la recherche qu'ils entendent mener est confié aux comités de protection des personnes.
Le b) prévoit pour les recherches interventionnelles autres que celles portant sur le médicament, pour lesquelles des dispositions spécifiques sont déjà prévues, l'élaboration de recommandations de bonnes pratiques par l'Afssaps.
Le c) prévoit l'élaboration de recommandations de bonnes pratiques tant pour les recherches interventionnelles présentant des risques et contraintes négligeables que pour les recherches observationnelles.
Le d) étend à l'ensemble des recherches sur la personne le contrôle exercé sur la qualité par des personnes mandatées par le promoteur. Cette action, complémentaire de celle des comités et de l'Afssaps, permet de garantir que la recherche une fois autorisée ne s'écartera pas du protocole validé.
Le 3° complète l'article L. 1121-4 du même code par trois alinéas. Le premier conditionne la mise en oeuvre de l'ensemble des catégories de recherche sur la personne à l' autorisation d'un comité de protection des personnes . Cette obligation est nouvelle tant pour les recherches présentant un risque et des contraintes négligeables que pour les recherches observationnelles. Le deuxième alinéa prévoit un recours des comités à l'Afssaps pour s'assurer que les produits utilisés dans le cadre de recherches déterminées parmi celles censées présenter un risque négligeable ne présentent pas un niveau de risque supérieur. Le troisième alinéa prévoit également un recours à l'Afssaps si un comité a un doute sérieux sur la qualification d'une recherche.
Le 4° insère un article L. 1121-8-1 qui revient sur l'interdiction édictée par l'article L. 1121-11 actuel de pratiquer des recherches sur des personnes n'ayant pas de sécurité sociale, c'est-à-dire essentiellement des immigrés en situation de précarité. Deux conditions sont imposées, dérivées de celles applicables pour la participation des personnes vulnérables :
- la recherche ne peut être conduite sur des personnes affiliées à la sécurité sociale ;
- il existe soit un bénéfice direct pour les personnes concernées, soit un bénéfice pour d'autres personnes placées dans une situation juridique semblable et de risques et contraintes minimisés. On peut penser que des recherches portant sur des maladies rares seraient ainsi rendues possibles.
Par coordination, le 5° supprime l'interdiction figurant au L. 1121-11.
Le 6° modifie l'article L. 1121-13. Il tire les conséquences de l'élargissement du cadre légal aux trois catégories de recherche sur la personne en matière de lieux de recherche.
Le 7° complète l'article L. 1121-15 par deux alinéas. Le premier crée un répertoire public des recherches présentant un risque et des contraintes négligeables et des recherches observationnelles sur le modèle de celui existant pour les recherches sur les médicaments. Le deuxième alinéa prévoit la publicité des résultats de la recherche dans des conditions définies par voie réglementaire.
Le 8° supprime la possibilité pour les comités de protection des personnes d'inscrire les participants à une recherche sur le fichier national prévu à l'article L. 1121-16, ce fichier semblant difficile à gérer pour la direction générale de la santé.
Les 9° et 10° prévoient les procédures d'appel :
- le 9° unifie les procédures d'appel pour l'ensemble des recherches en cas d'avis défavorable rendu par un comité sur une demande de recherche ;
- le 10° instaure une procédure d'appel identique en cas d'avis défavorable concernant la modification substantielle d'un protocole déjà autorisé. Un recours à l'Afssaps en cas de doute sur la catégorisation résultant d'une modification substantielle est également prévu.
Les 11°, 12° et 13° modifient respectivement les articles L. 1126-5, L. 1126-10 et l'intitulé du chapitre du titre II du livre premier de la première partie du code. Ils procèdent à des coordinations.
Le 14° modifie l'article L. 1122-1. Les a) , b) et c) procèdent à des coordinations afin de proportionner l'information donnée aux personnes aux risques encourus dans le cadre de la recherche. Le d) précise que les assistants et représentant légaux des personnes peuvent, le cas échéant, être informés à la place de celles-ci. Le e) supprime la notion de volontaires sains pour les recherches en matière de psychologie pour permettre une information succincte de toutes les personnes, quel que soit leur état de santé, dès lors qu'aucun risque sérieux n'est prévisible.
Le 15° propose une nouvelle rédaction de l'article L. 1122-1-1. Il présente une gradation des modes de recueil du consentement en fonction du risque présenté par la recherche. Le premier alinéa reprend le texte actuel de l'article. Il prévoit, pour les recherches interventionnelles, le recueil du consentement écrit ou, en cas d'impossibilité, attesté par un tiers indépendant du promoteur et de l'investigateur. Le deuxième alinéa prévoit simplement un consentement libre et éclairé pour les recherches interventionnelles présentant un risque et des contraintes négligeables. Un consentement écrit n'est pas nécessaire. Cette forme de recueil du consentement est alignée sur celle nécessaire pour les soins, la catégorie de recherche en cause n'étant pas censée présenter plus de risques que les soins. Pour les recherches observationnelles, une information simple est prévue, la non-opposition étant présumée puisque la recherche ne présente aucun risque.
Le 16° procède à une coordination au sein de l'article L. 1122-1-1.
Le 17° modifie l'article L. 1122-2.
Le a) prévoit la possibilité de procéder à une recherche sur un mineur en ayant recueilli le consentement d'un seul des deux titulaires de l'autorité parentale, dès lors qu'il s'agit d'une recherche présentant un risque et des contraintes négligeables ou d'une recherche observationnelle.
Le b) modifie l'article L. 1122-2, il procède à des coordinations.
Le 18° procède à des coordinations au sein de l'article L. 1221-8-1.
Le paragraphe III procède à des coordinations.
II - Le texte adopté par l'Assemblée nationale
La commission des affaires culturelles, familiales et sociales a adopté dix-sept amendements de précision rédactionnelle du rapporteur, dont un modifiant l'intitulé du titre II du livre I er de la première partie du code de la santé publique, qui devient « Recherches sur la personne » afin de correspondre au champ désormais plus large du titre auparavant consacré aux seules « recherches biomédicales ».
L'Assemblée nationale a ensuite adopté quatorze amendements présentés par l'auteur de la proposition de loi, Olivier Jardé : le premier prévoit que les recherches observationnelles peuvent être conduites par une personne qualifiée en matière de recherche qui n'est pas un professionnel de santé (pratiquement, il s'agit des recherches épidémiologiques qui sont souvent conduites par des biostatisticiens) ; le deuxième prévoit la publicité des résultats des recherches dans un délai raisonnable ; les autres procèdent à des modifications rédactionnelles et à des coordinations.
III - Le texte adopté par la commission
Votre commission est favorable à l'élaboration d'un cadre unique pour l'ensemble des recherches, qui permettra aux comités de protection des personnes de juger du caractère éthique de toutes les recherches menées et mettra fin aux contournements possibles par le jeu des qualifications entre recherche biomédicale, recherche en soins courants et recherche observationnelle.
Elle est toutefois très réservée sur la gradation des procédures de consentement prévues par la loi , même si elle reconnaît l'amélioration de l'information des personnes participant à une recherche observationnelle. Elle considère que l'ensemble des recherches interventionnelles doit être soumis à l'obligation de recueillir le consentement écrit des participants.
Elle a donc adopté vingt-sept amendements :
- trois amendements du rapporteur, le premier tend à préciser le champ d'application de la proposition de loi et lever une ambiguïté juridique sur les personnes susceptibles de participer aux recherches ; le deuxième tendant à supprimer la priorité nationale accordée au développement de la recherche sur la personne ; le troisième visant à mieux encadrer les définitions des différentes catégories de recherche ;
- deux amendements présentés par Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe, l'un tendant à préciser qu'une recherche présentant des risques minimes peut ne pas être conduite par un professionnel de santé, l'autre de nature rédactionnelle ;
- un amendement du rapporteur précisant qu'un CPP n'est pas tenu par l'avis de l'Afssaps sur la qualification d'un protocole de recherche ;
- deux amendements du groupe CRC-SPG encadrant les cas où une personne ne bénéficiant pas de la sécurité sociale peut participer à une recherche ;
- un amendement déposé par Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe tendant à supprimer l'autorisation nécessaire pour mener une recherche hors du lieu de soins quand elle présente un risque minime ;
- deux amendements du groupe CRC-SPG tendant à préserver la possibilité, pour les comités, d'inscrire des personnes participant à une recherche dans un fichier national et à rendre celui-ci consultable par tous les chercheurs ;
- un amendement du rapporteur tendant à mettre en place l'attribution aléatoire des protocoles de recherche pour examen par les CPP ;
- un amendement présenté par Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe tendant à permettre l'examen par les CPP des protocoles de recherches conduits dans les pays extérieurs de l'Union européenne par des promoteurs français ;
- un amendement du rapporteur tendant à prévoir une information individuelle des personnes participant aux recherches ;
- un amendement du groupe CRC-SPG tendant à renforcer l'information des participants l'issue de la recherche ;
- un amendement présenté par Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe permettant à l'investigateur de se faire représenter pour transmettre aux participants à un protocole de recherche les informations légales ;
- un amendement du rapporteur tendant à exiger un consentement écrit pour toutes les recherches interventionnelles ;
- quatre amendements du groupe CRC-SPG tendant respectivement : à permettre la prise en compte par les protocoles des cas d'urgence vitale sous le contrôle des CPP ; à revenir à l'obligation de recueillir le consentement des deux titulaires de l'autorité parentale pour la participation d'un enfant à une recherche quel qu'en soit le type ; à prévoir le consentement de la personne devenue majeure alors qu'elle participe à une recherche ; à prévoir la même obligation pour les personnes ayant recouvré la capacité légale à agir ;
- quatre amendent présentés par Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe, tendant respectivement à : simplifier le régime d'examen des protocoles de recherches appelés à se dérouler dans les collectivités d'outre-mer ; préciser les obligations d'information qui pèsent sur le promoteur à l'occasion de la fin d'une recherche ; apporter une précision rédactionnelle ; confier à l'Afssaps un pouvoir de police sur l'ensemble de la recherche ;
- un amendement du groupe CRC-SPG tendant à faire courir les délais en matière d'assurance à partir de la date de la majorité de l'enfant participant à une recherche ;
- un amendement du rapporteur tendant à la détermination par arrêté des types de tests conduits par l'industrie cosmétique et alimentaire et non soumis à l'autorisation d'un CPP.
Votre commission a adopté cet article ainsi modifié.
Article 2 - (art. L. 1121-16-1 du code de la santé publique) - Définition des recherches interventionnelles à finalité non commerciale
Objet : Cet article tend à mettre en conformité avec le droit communautaire le régime de prise en charge des médicaments utilisés dans la recherche par l'assurance maladie.
I - Le dispositif de la proposition de loi initiale
Cet article propose une nouvelle rédaction de l'article L. 1121-16-1 introduit dans le code de la santé publique par la loi du 18 avril 2006 de programmation pour la recherche. Il se compose de sept alinéas.
Le premier alinéa substitue à l'obligation que le promoteur d'une recherche soit sans but lucratif (« un organisme public de recherche, une université, un établissement public de santé, un établissement de santé privé participant au service public hospitalier » ou une personne privée sans but lucratif), celle que la recherche menée soit à finalité non commerciale , quel que soit le promoteur public ou privé, pour permettre la prise en charge intégrale du paiement des médicaments et dispositifs médicaux par l'assurance maladie.
Les recherches à but non commercial sont définies comme « les recherches dont les résultats ne sont pas exploités à des fins lucratives, qui poursuivent un objectif de santé publique et dont le promoteur ou le ou les investigateurs sont indépendants à l'égard des entreprises qui fabriquent ou qui commercialisent les produits faisant l'objet de la recherche ».
La notion est issue de la directive 2001/20/CE transposée par la loi de santé publique 31 ( * ) qui affirme, parmi les attendus du Parlement européen, que : « Des essais cliniques non commerciaux conduits par des chercheurs sans la participation de l'industrie pharmaceutique peuvent être très bénéfiques pour les patients concernés » .
Le deuxième alinéa précise que le promoteur prend en charge le coût des produits et dispositifs nécessaires à la recherche. Il en obtient le remboursement par les caisses d'assurance maladie dans les mêmes conditions que l'actuel article L. 1121-16-1, reprises dans les troisième, quatrième, cinquième et sixième alinéas.
Le septième alinéa prévoit le remboursement des caisses par le promoteur si la recherche ne correspond plus aux critères de la finalité non commerciale. Le montant à verser est déterminé par le ministre de la santé et susceptible d'appel.
II - Le texte adopté par l'Assemblée nationale
L'Assemblée nationale a adopté cinq amendements présentés par Olivier Jardé. Le premier tend à ouvrir la possibilité de qualifier des recherches à risques et contraintes négligeables comme étant à finalité non commerciale. Les quatre autres amendements sont de nature rédactionnelle ou de coordination.
III - Le texte adopté par la commission
Votre commission estime nécessaire d'encourager les recherches qui se proposent d'améliorer la santé publique en comparant les effets thérapeutiques de différents médicaments ou de diverses formes de prise en charge. La mise en conformité de ce dispositif avec le droit communautaire était nécessaire, s'agissant d'une aide d'Etat à la recherche, et la définition de modalités de remboursement à l'assurance maladie permet de prendre en compte l'éventuelle découverte de résultats ayant une finalité commerciale.
Elle a adopté deux amendements , l'un rédactionnel, l'autre de coordination, présentés par Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe
Votre commission a adopté cet article ainsi modifié.
Article 3 - (art. L. 1123-7, L. 1243-3 et L. 1243-4 du code de la santé publique) - Simplification et mise en cohérence du régime d'autorisation et de déclaration des recherches utilisant des collections d'échantillons biologiques humains
Objet : Cet article vise à simplifier le régime d'autorisation, par les comités de protection des personnes, des collections biologiques.
I - Le dispositif de la proposition de loi initiale
Ce dispositif remplace l'avis des comités de protection des personnes sur les déclarations de constitution de collections biologiques par un examen dans le cadre des protocoles de recherche et précise certains critères d'appréciation des recherches soumises à l'avis de ces comités.
Le 1° modifie l'article L. 1123-7 du code de la santé publique relatif aux critères utilisés par les comités pour rendre leur avis sur une recherche.
Le a) précise les modalités de recueil du consentement pour les recherches non interventionnelles.
Le b) insère un alinéa tendant à ce que les comités analysent « la pertinence scientifique et éthique des projets de constitution de collections d'échantillons biologiques » dans le cadre des protocoles soumis.
Le c) limite aux recherches interventionnelles la nécessité de préciser dans le protocole soumis si un comité de surveillance indépendant est ou non prévu.
Le 2° modifie l'article L. 1243-3 du même code.
Le a) supprime la nécessité d'un avis préalable d'un comité sur les constitutions de collections biologiques, cet examen étant désormais conduit dans le cadre de celui des protocoles de recherche. Les b) , c) et d) procèdent à des coordinations.
Le 3° modifie l'article L. 1243-4 du même code.
Le a) complète l'énumération des types de collections devant faire l'objet d'un examen par les comités dans le cadre des protocoles.
Le b) supprime l'avis, sur la constitution des collections, du comité consultatif sur le traitement de l'information en matière de recherche dans le domaine de la santé.
II - Le texte adopté par l'Assemblée nationale
La commission a adopté deux amendements du rapporteur, l'un rédactionnel, l'autre de cohérence, ainsi que six amendements de précision déposés en séance publique par Olivier Jardé.
III - Le texte adopté par la commission
Votre commission est favorable à ce dispositif qui clarifie les conditions du contrôle des comités de CPP sur les collections biologiques.
Elle a adopté deux amendements , l'un rédactionnel, l'autre tendant à corriger une erreur matérielle, déposés par Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe.
Votre commission a adopté cet article ainsi modifié.
Article 4 - (art. L. 1123-1 et L. 1123-5 du code de la santé publique) - Statut juridique et conditions de retrait d'agrément des comités de protection des personnes
Objet : Cet article clarifie le statut des comités de protection des personnes et permet de supprimer ceux dont l'activité est insuffisante.
I - Le dispositif de la proposition de loi initiale
Le paragraphe I modifie l'article L. 1123-1 du code de la santé publique. Il accorde la personnalité juridique de droit public aux comités et précise qu'ils exercent leur mission en toute indépendance.
Le paragraphe II modifie l'article L. 1123-5 du même code. Il ouvre la possibilité au ministre de retirer l'agrément d'un comité si l'activité de celui-ci est insuffisante, le contenu de cette notion devant être précisé par voie réglementaire.
L'Assemblée nationale a adopté cet article sans modification.
II - Le texte adopté par la commission
Votre commission est favorable à la clarification du statut des CPP, ce qui devrait permettre de faciliter leur activité et de mieux l'évaluer. La possibilité de retrait d'un agrément, dès lors qu'il repose sur des critères objectifs, est également conforme au souci de qualité des décisions prises, les comités étudiant un faible nombre de dossiers n'étant pas capable d'établir une jurisprudence cohérente et complète.
Elle a adopté deux amendements identiques présentés par les membres du groupe CRC-SPG et du groupe socialiste tendant à la suppression du critère quantitatif pour le retrait de l'agrément d'un CPP par le ministre en charge de la santé.
Votre commission a adopté cet article ainsi modifié.
Article 4 bis (nouveau) - (art. L. 5126-1 du code de la santé publique) -Distribution des produits, substances ou médicaments nécessaires à la recherche
Objet : Cet article additionnel simplifie le régime de distribution des produits, substances ou médicaments nécessaires à la recherche.
Introduit à l'initiative de Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe, cet article additionnel supprime la nécessité d'une autorisation de l'Afssaps et renvoie à un décret le soin de déterminer les cas dans lesquels les pharmacies à usage intérieur des établissements ayant effectué des recherches pourront distribuer les produits, substances ou médicaments ayant fait l'objet de ces recherches aux pharmacies à usage intérieur d'autres établissements de santé.
Votre commission a adopté cet article additionnel ainsi rédigé.
Article 4 ter (nouveau) - (art. L. 1125-3 du code de la santé publique) - Mise en cohérence du code de la santé publique et du code de l'environnement
Objet : Cet article additionnel organise la cohérence du code de la santé publique avec le code de l'environnement.
Introduit à l'initiative de Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe, cet article additionnel permet de mettre en cohérence l'article L. 1125-3 du code de la santé publique avec l'article L. 533-3 du code de l'environnement, relatif à la dissémination volontaire d'organismes génétiquement modifiés. A cette fin, le renvoi à l'article L. 5311-1 du code de la santé publique qu'opère l'article L. 1125-3 est supprimé. En effet, cet article limite le recours à l'autorisation préalable de l'Afssaps aux seules expérimentations portant sur des produits à finalité sanitaire ou cosmétique tandis que l'article L. 533-3 du code de l'environnement requiert une autorisation pour toute dissémination volontaire d'OGM, et non uniquement pour celles relatives à des produits à finalité sanitaire ou cosmétique.
Votre commission a adopté cet article additionnel ainsi rédigé.
Article 4 quater (nouveau) - (art. L. 5124-9 du code de la santé publique) - Régime des médicaments radiopharmaceutiques et de certains médicament élaborés dans le cadre de la recherche
Objet : Cet article additionnel tend à simplifier le régime applicable aux médicaments radiopharmaceutiques et à certains médicaments élaborés dans le cadre de recherches sur la personne.
Introduit à l'initiative de Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Férat, Adrien Giraud, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard et Jean-Marie Vanlerenberghe, cet article permet aux établissements publics et organismes privés à but non lucratif de fabriquer, d'importer et de distribuer des médicaments radiopharmaceutiques ou certains médicaments élaborés dans le cadre de recherches sur la personne afin de faciliter leur usage. L'élaboration de ces médicaments radiopharmaceutiques reste soumise à un régime d'autorisation spécifique par l'autorité de sureté nucléaire, complémentaire de celui de l'Afssaps.
Votre commission a adopté cet article additionnel ainsi rédigé.
Article 4 quinquies (nouveau) - (art. L. 1123-1-1 nouveau du code de la santé publique) - Création d'une commission nationale des recherches impliquant la personne humaine
Objet : Cet article additionnel prévoit la création d'une instance nationale indépendante chargée de coordonner l'activité des comités de protection des personnes.
Introduit à l'initiative du rapporteur, cet article additionnel crée une instance de coordination de l'action des CPP. Déjà envisagée depuis plusieurs années, elle devra refléter la composition des CPP et être constituée à parité entre scientifiques et personnes issues de la société civile.
Cette commission nationale des recherches impliquant la personne humaine sera placée auprès de la Haute Autorité de santé (HAS) plutôt qu'auprès du ministère de la santé, afin de garantir son indépendance. Elle sera chargée d'élaborer une « jurisprudence » des comités en se chargeant du second examen des dossiers ayant reçus un avis défavorable et de coordonner leur action. De plus l'évaluation de l'action des comités lui sera confiée, ce qui permettra la mise en oeuvre du protocole déjà élaboré à cette fin par la HAS.
Enfin la commission nationale sera une instance de proposition, tant en matière législative et réglementaires que pour indiquer les résultats des recherches les plus intéressantes qu'il est important de traduire dans les faits.
Votre commission a adopté cet article additionnel ainsi rédigé.
Article 4 sexies (nouveau) - Possibilité de dérogation à la procédure de contrôle du traitement de l'information
Objet : Cet article additionnel prévoit la possibilité d'une dérogation au passage prévu devant le CCTIRS en cas d'avis favorable d'un CPP.
Introduit à l'initiative de Sylvie Desmarescaux, cet article tend à remédier au fait que la proposition de loi n'aborde pas la question de l'examen des protocoles de recherches non interventionnelles par le comité consultatif sur le traitement de l'information en matière de recherche dans le domaine de la santé (CCTIRS) créé en 2004, ce qui risque d'alourdir considérablement les procédures. Il convient donc de prévoir un système dérogatoire dans l'attente d'une concertation organisée entre le ministère de la santé, le ministère de la recherche et la Cnil pour parvenir à une réforme des procédures prévues par la loi de 1978.
Votre commission a adopté cet article additionnel ainsi rédigé.
Article 4 septies - Interdiction du test de la dose maximum tolérée pour un médicament sans lien avec la pathologie de la personne à laquelle il est administré
Objet : Cet article additionnel tend à interdire de conduire des tests de dosage létal d'un médicament sur des personnes pour lesquelles il ne peut apporter aucun soin.
Introduit à l'initiative de Nicolas About, cet article tend à mettre fin à une pratique spécifique aux essais dits de phase I sur les médicaments innovants anti-cancéreux. Pour ceux-ci, en effet, le test de la dose maximum tolérée du produit est une norme internationale permettant la validation de l'essai. Ce test est conduit sur la base de l'hypothèse que la plus forte efficacité thérapeutique se situe juste en dessous de la dose létale. Il aboutit concrètement à administrer à six malades en fin de vie une dose de médicament susceptible de les tuer. Cette pratique pose en elle-même d'importants problèmes éthiques sur lesquels le CCNE 32 ( * ) a été appelé à se pencher. Une révision de l'encadrement de ces pratiques semble donc nécessaire.
Toutefois il a semblé dès à présent et a minima nécessaire à votre commission d'interdire les tests de dose maximum acceptable pour un médicament sans lien avec la pathologie de la personne à laquelle il est administré. La pratique semble en effet accepter qu'un médicament censé soigner un type de cancer puisse être testé pour la dose maximum sur des personne souffrant d'une autre forme de cette maladie.
Votre commission a adopté cet article additionnel ainsi rédigé.
Article 5 - Entrée en vigueur de la loi
Objet : Cet article conditionne l'entrée en vigueur de la loi à la parution des décrets d'application qu'elle prévoit.
I - Le dispositif proposé par l'Assemblée nationale
L'Assemblée nationale a adopté, à l'initiative d'Olivier Jardé, cet article tendant à ce que la loi entre en application d'un seul bloc, au moment de la parution des décrets, afin d'éviter tout régime transitoire qui fragiliserait l'étude des dossiers de recherche.
II - Le texte adopté par la commission
Votre commission est favorable à cette disposition qui facilitera la mise en oeuvre de la loi et qui place le pouvoir réglementaire face à ses responsabilités.
A l'initiative de son rapporteur, elle lui a apporté une modification de cohérence puis elle a adopté cet article ainsi modifié.
Intitulé de la proposition de loi
Pour tenir compte des amendements précédemment adoptés à l'initiative de son rapporteur, votre commission a intitulé comme suit la présente proposition de loi : « Proposition de loi relative aux recherches clinique et non interventionnelle impliquant la personne humaine ».
*
* *
Lors de sa réunion du 14 octobre 2009, la commission des affaires sociales a adopté le texte de la présente proposition de loi tel que modifié.
TRAVAUX DE LA COMMISSION
Réunie le mercredi 14 octobre 2009 , sous la présidence de Muguette Dini, présidente , la commission a procédé, sur le rapport de Marie-Thérèse Hermange , à l'examen des amendements et à l'élaboration du texte qu'elle propose pour la proposition de loi n° 177 rectifié (2008-2009), adoptée par l'Assemblée nationale, relative aux recherches sur la personne .
Marie-Thérèse Hermange , rapporteur, a rappelé que cette proposition de loi, déposée le 6 janvier 2009, a été adoptée par l'Assemblée nationale le 22 janvier suivant. Le retard pris pour son examen par le Sénat résulte de l'adoption du texte portant réforme de l'hôpital au cours du deuxième trimestre mais ce délai lui a permis de procéder à une quinzaine d'auditions et d'effectuer une visite de terrain à Marseille.
La proposition de loi tend à faire évoluer le cadre légal des recherches médicales appliquées sur l'homme. La recherche appliquée peut être menée selon deux modalités distinctes : la recherche clinique, qui permet d'expérimenter de nouveaux traitements, et la recherche dite observationnelle ou non interventionnelle, c'est-à-dire notamment l'épidémiologie. Dans les deux cas, c'est l'homme qui est utilisé pour vérifier les hypothèses et pour faire progresser les connaissances, ce qui impose de contrôler ces recherches d'un point de vue éthique afin de protéger la dignité de la personne.
Actuellement, deux textes régissent les recherches sur la personne : la loi « informatique et liberté » de 1978 et, pour les recherches biomédicales sur l'être humain, la loi du 20 décembre 1988, dite « Huriet-Sérusclat ». Ils ont institué un régime de contrôle et d'autorisation dont la mise en oeuvre est confiée à différentes institutions :
- d'une part, pour le traitement des données, la commission nationale informatique et libertés (Cnil) et son comité préparatoire, le comité consultatif sur le traitement de l'information en matière de recherche dans le domaine de la santé (CCTIRS) ;
- d'autre part, pour ce qui concerne la protection de l'intégrité physique des personnes et la garantie de l'éthique de la recherche, l'agence française de sécurité sanitaire des produits de santé (Afssaps) et les comités de protection des personnes (CPP).
Composés de sept représentants de la société civile et de sept scientifiques, ces comités sont obligatoirement consultés avant qu'un projet de recherche clinique soit autorisé ; leur avis peut également être sollicité sur un projet de recherche non interventionnelle. Outre la protection de l'intégrité physique des personnes, ils veillent à s'assurer du consentement des individus qui participent à ces recherches. L'intervention de ces comités est indispensable au regard du droit communautaire mais aussi pour favoriser la publication des travaux des chercheurs dans les revues médicales de renommée internationale, qui n'acceptent que des articles validés par un comité d'éthique.
La proposition de loi renforce encore la place dévolue à ces comités en unifiant, sous leur égide, le contrôle de l'éthique des protocoles de recherche sur la personne, ce qui présente un triple avantage :
- d'abord, les comités seraient désormais obligatoirement saisis de tous les projets de recherche sur les personnes, qu'ils aient un caractère clinique ou non interventionnel ;
- ensuite, cette unification devrait favoriser une homogénéisation des appréciations portées en matière d'éthique de la recherche ;
- enfin, les CPP auraient le pouvoir de requalifier les projets de recherche qui leur sont soumis afin de leur appliquer le régime juridique adéquat.
Ce dernier point est important car il permettra d'éviter que des chercheurs qualifient d'observationnelle une recherche qui présente en réalité un caractère clinique, dans le seul but d'appliquer des règles juridiquement moins contraignantes en matière de consentement des personnes.
La réforme du contrôle des recherches sur la personne figure dans l'article premier de la proposition de loi. Son article 4 dote les CPP de la personnalité morale de droit public et prévoit la possibilité de mettre fin à l'existence de ceux dont l'activité est insuffisante. Les articles 2 et 3 définissent le régime des recherches à finalité non commerciale, nouvelle notion issue du droit communautaire, et simplifient la procédure de déclaration de collections biologiques. Enfin, l'article 5 subordonne l'entrée en vigueur du texte à celle de ses décrets d'application.
Marie-Thérèse Hermange , rapporteur, a estimé que plusieurs problèmes demeurent néanmoins. En premier lieu, la proposition de loi remplace la notion de « recherches visant à évaluer les soins courants » par celle de « recherches interventionnelles ne comportant que des risques et des contraintes négligeables », qui seraient soumises à des règles de consentement simplifiées. Cependant, cette nouvelle catégorie ne s'appliquerait pas aux recherches sur le médicament, qui sont régies par des règles de droit communautaire plus rigoureuses. Cette exclusion met en évidence le caractère arbitraire de cette notion de « risque négligeable », qui n'est définie dans aucun texte. De plus, les personnes participant à des « recherches à risques et contraintes négligeables » devraient désormais fournir un consentement libre et éclairé, sans autre précision, alors que les CPP exigent actuellement un consentement écrit pour la quasi-totalité des recherches interventionnelles. Il ne paraît pas opportun de revenir sur cet état de fait.
En second lieu, les CPP sont confrontés à deux difficultés essentielles : l'écart important entre le nombre de dossiers traités par les différents comités et l'absence d'harmonisation de leurs décisions.
Enfin, le contrôle de l'utilisation des données personnelles constitue un problème délicat. Or, la proposition de loi néglige la réforme de la procédure devant le CCTIRS, pourtant souhaitée par tous les acteurs de la recherche, voire alourdit la procédure en vigueur en obligeant les chercheurs à passer obligatoirement devant un CPP avant de soumettre leur protocole de recherche au CCTIRS.
En conclusion, elle a indiqué qu'elle proposera à la commission onze amendements, visant notamment à clarifier la notion de recherche interventionnelle présentant des risques et des contraintes négligeables, à exiger un consentement écrit pour la participation à toute recherche interventionnelle et à prévoir la création d'une instance indépendante chargée de coordonner l'action des CPP.
Rappelant que le texte avait été examiné à l'Assemblée nationale dans un délai très court, Jean-Pierre Godefroy a déploré que la commission n'ait organisé aucune audition sur ce sujet fort complexe et que le rapporteur n'ait pas non plus jugé opportun d'ouvrir ses auditions aux autres commissaires. C'est la raison pour laquelle le groupe socialiste n'a déposé à ce stade que quelques amendements de suppression, réservant ses propositions pour la séance publique.
Il a ensuite demandé pourquoi le texte prend la forme d'une proposition de loi, alors qu'il aurait pu trouver sa place dans la future réforme de la loi de bioéthique ; peut-être est-ce une manière d'éviter un passage devant le Conseil d'Etat et l'élaboration d'une étude d'impact, qui aurait pourtant permis d'éclairer les débats.
Sur le fond, il a estimé que le texte affaiblit les dispositions destinées à protéger les personnes dans le seul but de faciliter la recherche médicale. Il a jugé difficile de savoir si une recherche présente un risque négligeable avant qu'elle ait été effectivement réalisée et a considéré que plusieurs dispositions du texte sont inacceptables en l'état :
- les personnes non affiliées à un régime de sécurité sociale, et notamment les plus vulnérables comme les immigrés en situation irrégulière par exemple, pourraient être amenées à accepter de participer à des recherches médicales, le cas échéant pour bénéficier de traitements auxquels ils n'ont pas accès pour des raisons financières ;
- en cas d'avis négatif d'un CPP, le ministre de la santé aurait le droit de solliciter l'avis d'un autre comité de son choix, ce deuxième comité pouvant éventuellement se montrer plus complaisant ;
- pour les mineurs, l'autorisation de participer à un protocole de recherche pourrait être donnée par un seul titulaire de l'autorité parentale, ce qui risque, en cas de conflit entre les parents, d'être une source de difficultés préjudiciables à l'enfant : l'avis des deux parents doit donc impérativement être requis.
Plus généralement, il convient d'encadrer strictement les cas où une personne qui n'est plus en état d'exprimer son consentement pourrait se trouver incluse dans un protocole de recherche.
Isabelle Debré a déclaré partager la remarque relative à l'exercice de l'autorité parentale puis a demandé comment et par qui sont choisis les membres des CPP.
A son tour, François Autain a regretté que le rapporteur n'ait pas convié les autres commissaires à assister à ses auditions ni à participer au déplacement organisé à Marseille. Sur le fond, il a considéré que le texte donne la priorité à la recherche aux dépens de la protection des personnes : l'article premier indique ainsi que « le développement de la recherche sur la personne constitue une priorité nationale ». Il s'est opposé à l'idée de procéder à des recherches cliniques sur des personnes non affiliées à la sécurité sociale, au motif que ces personnes fragiles pourraient être victimes de pratiques abusives. Il a demandé que le rôle des CPP soit renforcé, que leurs décisions soient harmonisées et qu'une instance nationale soit créée, avec le pouvoir de décider quel comité sera chargé d'évaluer tel ou tel projet de recherche. Actuellement, c'est le promoteur de la recherche qui choisit le CPP auquel il va soumettre son projet, avec le risque qu'il retienne le comité le moins exigeant. De ce point de vue, on peut se demander si les CPP qui traitent le plus faible nombre de dossiers, et que la proposition de loi entend précisément faire disparaître, ne sont pas justement les plus rigoureux et les plus sérieux, ce qui expliquerait que certains chercheurs les évitent.
Catherine Procaccia a indiqué faire confiance au rapporteur, sur cette matière très technique, pour trouver le bon équilibre entre les nécessités de la recherche et la protection des personnes. Elle a fait valoir qu'il est parfois nécessaire de mener des recherches à l'étranger, le cas échéant auprès de personnes qui ne disposent d'aucune protection sociale, pour étudier des pathologies qui n'existent pas sous nos latitudes.
Jacky Le Menn a précisé que l'on peut, schématiquement, distinguer deux grandes tendances dans la recherche contemporaine : dans les pays anglo-saxons, le chercheur s'efforce de travailler rapidement pour obtenir le meilleur retour sur investissement ; l'approche française met davantage l'accent sur la protection des personnes. Cette proposition de loi tend à rapprocher la France du modèle anglo-saxon, sans apporter de justification convaincante à une telle évolution.
Marie-Thérèse Hermange , rapporteur, a fait observer que l'inscription de ce texte à l'ordre du jour du Sénat a été décidée voici quelques semaines seulement, ce qui n'a laissé que peu de temps pour organiser le travail de préparation et n'a pas permis la tenue d'auditions en commission. Elle s'est ensuite réjouie que les remarques formulées par ses collègues rejoignent ses propres préoccupations, par exemple sur la question du risque négligeable, de l'autorité parentale ou encore des personnes non affiliées à la sécurité sociale. Elle a affirmé que le texte, une fois amendé, améliorerait la protection des personnes. Répondant à la question plus ponctuelle de la composition des CPP, elle a précisé que leurs membres sont tirés au sort parmi des personnes volontaires.
Puis, la commission a procédé à l'examen des amendements.
|
Article 1 er |
|||
|
Auteur |
N° |
Objet |
Sort de l'amendement |
|
Groupe socialiste |
26 |
Suppression de l'article |
Retiré |
|
Rapporteur |
1 |
Précision du champ d'application de la proposition de loi |
Adopté |
Marie-Thérèse Hermange , rapporteur, a expliqué que l'amendement n° 1 vise à préciser le champ des recherches couvertes par la proposition de loi et à lever une ambiguïté en faisant référence aux recherches « impliquant la personne humaine » et non aux « recherches sur la personne ». En effet, un individu en état de mort cérébrale n'est plus considéré comme une « personne », au sens juridique du mot, mais doit pourtant être protégé. En outre, cette nouvelle rédaction aurait pour intérêt de souligner que les personnes qui participent aux recherches ne doivent pas être considérées comme des objets.
A Jean-Pierre Godefroy qui demandait si l'engagement de recherches sur une personne en état de mort cérébrale serait toujours subordonné à son consentement préalable, Marie-Thérèse Hermange , rapporteur, a répondu par l'affirmative.
Gilbert Barbier a estimé qu'utiliser la formule de « personne humaine » s'apparente à un pléonasme.
François Autain ayant proposé de faire référence aux « recherches menées au bénéfice de la personne », Marie-Thérèse Hermange , rapporteur, a fait valoir que cette formulation marquerait un retour à la distinction ancienne entre recherches « avec » ou « sans » bénéfice direct. Or, la recherche doit être bien distinguée des soins : ceux-ci ont un bénéfice direct pour l'individu, la recherche vise avant tout à améliorer les connaissances.
Dans un souci de conciliation, Françoise Henneron a suggéré de faire référence à « l'être humain ».
Marie-Thérèse Hermange , rapporteur, a cependant redouté que l'emploi de cette expression pose la question complexe du statut de l'embryon.
|
Article 1 er |
|||
|
Auteur |
N° |
Objet |
Sort de l'amendement |
|
Rapporteur |
2 |
Suppression de la priorité nationale accordée à la recherche sur la personne |
Adopté |
|
Groupe CRC - SPG |
12 |
Obligation de conduire les recherches au bénéfice de la personne |
Retiré |
|
Rapporteur |
3 |
Nouvelle définition des catégories de recherches |
Adopté |
|
Groupe CRC - SPG |
23 |
Obligation de faire participer un pédiatre aux délibérations concernant un protocole impliquant des mineurs de moins de seize ans |
Retiré |
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
46 |
Possibilité pour une personne qualifiée, et non seulement pour un professionnel de santé, de mener des recherches présentant un risque et des contraintes négligeables |
Adopté |
|
43 |
Amendement rédactionnel |
||
|
Rapporteur |
4 |
Précision que le comité n'est pas tenu par l'avis de l'Afssaps en matière de détermination de la catégorie de recherche de laquelle relève le protocole |
Adopté |
|
Groupe CRC - SPG |
13 |
Restriction de la possibilité pour les personnes non affiliées à la sécurité sociale de participer à un protocole aux seuls cas de recherches non interventionnelles |
Adopté |
|
14 |
Possibilité de dérogation accordée par un CPP pour la participation de personnes non affiliées à la sécurité sociale à des recherches interventionnelles |
||
François Autain a indiqué que les amendements n os 13 et 14 autorisent la participation des personnes non affiliées à un régime de sécurité sociale aux seules recherches non interventionnelles, sauf dérogation accordée par un CPP.
Jean-Pierre Godefroy s'est inquiété des conséquences potentielles de cette possibilité de dérogation : des personnes démunies pourraient être tentées d'accepter de participer à un protocole de recherches pour être soignées gratuitement.
Isabelle Debré a exprimé la même préoccupation, des personnes sans ressources pouvant être amenées à participer à des recherches pour des raisons financières.
François Autain a répondu que cette possibilité de dérogation est demandée par les CPP et que ces dérogations, qui présenteraient un caractère exceptionnel, devraient être motivées.
Nicolas About a estimé qu'un malade devrait pouvoir bénéficier d'une nouvelle molécule, dans le cadre d'un protocole de recherche, même s'il n'est pas affilié à la sécurité sociale.
|
Article 1 er |
|||
|
Auteur |
N° |
Objet |
Sort de l'amendement |
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
42 |
Suppression de l'autorisation requise pour mener des recherches sur la personne hors des lieux de soins lorsqu'elles ne comportent que des risques et des contraintes négligeables |
Adopté |
|
Groupe CRC - SPG |
16 |
Maintien de la possibilité pour les CPP d'inscrire dans le fichier national les personnes se prêtant à des recherches |
Adopté |
|
15 |
Possibilité pour tout investigateur de consulter le fichier |
||
|
Rapporteur |
5 |
Désignation aléatoire du CPP chargé d'examiner un protocole de recherches |
Adopté |
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
48 |
Amendement de coordination |
Tombe |
|
41 rect. |
Possibilité pour un promoteur ayant son siège en France de soumettre à un CPP un projet de recherche sur la personne dans un pays tiers à l'Union européenne |
Adopté |
|
|
Rapporteur |
6 |
Maintien du principe de l'information individuelle des personnes participant à la recherche |
Adopté |
|
Groupe CRC - SPG |
17 |
Maintien du principe de l'information individuelle des personnes participant à la recherche |
Retiré |
|
18 |
Information des personnes de la fin de la recherche et de la date de recevabilité d'une première réclamation |
Adopté |
|
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
40 |
Possibilité pour l'investigateur de se faire représenter pour délivrer les informations légales |
Adopté |
|
Rapporteur |
7 |
Obligation d'un consentement écrit pour la participation à toute recherche interventionnelle |
Adopté |
|
Groupe CRC - SPG |
19 |
Possibilité pour un CPP, en cas d'urgence vitale, d'autoriser une dérogation aux règles de consentement habituellement requises |
Adopté |
|
20 |
Obligation du consentement des deux titulaires de l'autorité parentale pour la participation d'un mineur à une recherche |
||
|
Rapporteur |
8 |
Possibilité de dérogation sous le contrôle d'un CPP à l'obligation de recueil du consentement des deux titulaires de l'autorité parentale |
Retiré |
Marie-Thérèse Hermange , rapporteur, a indiqué que l'amendement n° 8 prévoit que le consentement des deux parents doit être recueilli pour que des recherches interventionnelles puissent être menées sur un mineur. Toutefois, une dérogation à ce principe pourrait être autorisée par le CPP dans des cas exceptionnels, à condition que le parent n'ayant pas donné son accord en soit informé et conserve la faculté de s'y opposer.
Jean-Pierre Godefroy a estimé que ce dispositif risque d'être source de contentieux si l'information parvient au titulaire de l'autorité parentale alors que la recherche a déjà commencé. En cas de désaccord entre les parents, l'enfant se trouvera, en outre, au centre de ce conflit familial. Enfin, on peut douter de l'articulation entre ces nouvelles dispositions et celles figurant dans le code civil en matière d'autorité parentale.
Isabelle Debré s'est également inquiétée des conséquences que pourrait avoir cette possibilité de dérogation et a demandé comment, sur le plan pratique, l'information serait délivrée au titulaire de l'autorité parentale qui n'a pas donné son accord.
Marie-Thérèse Hermange , rapporteur, a justifié sa décision de présenter cet amendement par deux raisons principales : d'une part, parce qu'il faut faire confiance aux CPP, qui vont être réformés par la proposition de loi ; d'autre part, parce qu'il serait dommage d'exclure un enfant gravement malade d'un protocole de recherches, sans aucune possibilité de recours, au motif que l'un des parents n'a pas donné son accord, pour des motifs qui peuvent être divers.
Colette Giudicelli a cependant estimé qu'autoriser une telle dérogation équivaudrait à ouvrir la boîte de Pandore.
Nicolas About a considéré qu'il n'appartient pas aux CPP de priver l'un des titulaires de l'autorité parentale de ses droits : seule une intervention du juge devrait permettre de passer outre l'opposition de l'un des deux parents.
Alain Milon ayant fait observer que l'intervention du juge risque d'allonger considérablement les délais, ce qui peut être préjudiciable à l'enfant, Nicolas About a objecté que ce genre de décision peut être prise rapidement en procédure de référé.
Au terme de ce débat, Marie-Thérèse Hermange , rapporteur, a retiré l'amendement n° 8 et la commission a adopté l'amendement n° 20 consacrant le consentement obligatoire des deux parents dans le cas des recherches impliquant un mineur.
|
Article 1 er |
|||
|
Auteur |
N° |
Objet |
Sort de l'amendement |
|
Groupe CRC - SPG |
21 |
Information du mineur devenu majeur au cours de sa participation à une recherche |
Adopté |
|
22 |
Information de la personne ayant acquis la capacité juridique au cours de sa participation à une recherche |
||
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
38 |
Suppression de l'obligation d'adapter la composition d'un CPP pour statuer sur des projets de recherches devant être réalisées sur les territoires de Wallis-et-Futuna, de Nouvelle-Calédonie et de Polynésie française |
Adopté |
|
Groupe CRC - SPG |
24 |
Fixation à la date de la majorité des mineurs ayant participé à une recherche du point de départ du délai de recours en matière d'assurance |
Adopté |
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
29 |
Clarification des informations données par le promoteur |
Adopté |
|
30 |
Amendement rédactionnel |
||
|
33 |
Pouvoirs de police de l'Afssaps sur l'ensemble des recherches sur la personne |
||
|
Rapporteur |
9 |
Amendement de coordination |
Retiré |
|
10 |
Détermination par arrêté des types de tests conduits par l'industrie cosmétique et alimentaire et non soumis à autorisation par un CPP |
Adopté |
|
La commission a alors adopté l'article 1 er ainsi modifié.
|
Article 2 |
|||
|
Auteur |
N° |
Objet |
Sort de l'amendement |
|
Groupe socialiste |
27 |
Suppression de l'article |
Retiré |
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
44 |
Amendement rédactionnel |
Adopté |
|
32 |
Amendement de coordination |
||
La commission a ensuite adopté l'article 2 ainsi modifié.
|
Article 3 |
|||
|
Auteur |
N° |
Objet |
Sort de l'amendement |
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
45 |
Amendement rédactionnel |
Adopté |
|
34 |
Correction d'une erreur matérielle |
||
La commission a alors adopté l'article 3 ainsi modifié.
|
Article 4 |
|||
|
Auteur |
N° |
Objet |
Sort de l'amendement |
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
47 |
Mise en place auprès du ministre de la santé d'une commission nationale de la recherche sur la personne |
Retiré |
|
Groupe CRC - SPG |
25 |
Suppression de l'introduction de critères quantitatifs pour le retrait de l'agrément d'un CPP par le ministre |
Adopté |
|
Groupe socialiste |
28 |
||
La commission a ensuite adopté l'article 4 ainsi modifié.
|
Articles additionnels après l'article 4 |
|||
|
Auteur |
N° |
Objet |
Sort de l'amendement |
|
Nicolas About, Jean-Paul Amoudry, Didier Borotra, Marcel Deneux, Muguette Dini, Françoise Ferrat, Catherine Morin-Desailly, Anne-Marie Payet, Jean-Jacques Pignard, Jean-Marie Vanlerenberghe |
35 |
Possibilité pour les pharmacies à usage intérieur de distribuer les produits ayant fait l'objet de recherches aux pharmacies à usage intérieur d'autres établissements de santé |
Adopté |
|
36 |
Amendement de cohérence |
||
|
37 |
Simplification du régime applicable aux médicaments radiopharmaceutiques ou à certains médicaments élaborés dans le cadre de recherches sur la personne |
||
|
Rapporteur |
11 |
Création d'une commission nationale des recherches impliquant la personne humaine auprès de la Haute Autorité de santé |
Adopté |
|
Sylvie Desmarescaux |
50 |
Possibilité de dérogation à la procédure mise en place par la loi du 6 janvier 1978 modifiée |
Adopté |
|
Nicolas About |
49 rect. |
Interdiction du test de la dose maximum tolérée d'un médicament administré sans lien avec la pathologie de la personne |
Adopté |
Puis la commission a adopté l'article 5, pour tenir compte de l'adoption de l'amendement n° 11 instituant une commission nationale des recherches impliquant la personne humaine.
Elle a ensuite modifié l'intitulé de la proposition de loi par coordination avec les positions prises précédemment.
|
Intitulé de la proposition de loi |
|||
|
Auteur |
N° |
Objet |
Sort de l'amendement |
|
Rapporteur |
51 |
Proposition de loi relative aux recherches clinique ou non interventionnelle impliquant la personne humaine |
Adopté |
Enfin, la commission a adopté le texte de la proposition de loi tel qu'il résulte de ses travaux.
LISTE DES PERSONNES AUDITIONNÉES PAR LE RAPPORTEUR
•
Jean Marimbert,
directeur
général,
Chantal Belorgey,
chef de
département,
Carole Le Saulnier,
adjointe au service
des affaires juridiques, et
Pierre-Henri Bertoye
, chef de
département de l'agence française de sécurité
sanitaire et des produits de santé (Afssaps)
•
Dominique de Javel
et
Héloïse Tarraud
, directrice des relations
extérieures, Alliance 7
•
Marc Morel
, directeur, et
Marie-Annick Lambert
, vice-présidente du collectif
inter associatif sur la santé (Ciss)
•
Docteur Mahmoud Zureik
,
président du comité consultatif sur le traitement de
l'information en matière de recherche dans le domaine de la santé
(CCTIRS)
•
Professeur Jean-Louis Bernard
,
coordinateur du cercle « éthique de la recherche chez
l'enfant », président du Comité de protection des
personnes Sud-Méditerranée 2
•
Docteur Valérie Plattner
,
secrétaire de la coordination des promoteurs institutionnels,
Ingrid Cailles
, de l'Institut Pasteur,
Olivier Chassany
de l'Assistance publique des hôpitaux de Paris, et
Valérie Lemahieu-Monribot,
de l'agence nationale de
recherche sur le sida (ANRS)
•
Elisabeth Frija-Orvoen
,
présidente,
Thierry Delangre
, secrétaire
général, et
Philippe Rusch
, trésorier de
la conférence nationale des comités de protection des personnes
(CNCP)
•
Elizabeth Devilliers
,
coordinatrice,
Professeur Christian Thuillez
(CHU de Rouen),
Professeur Norbert Ifrah
(CHU d'Angers),
Professeur
Michel Slama
(CHU d'Amiens), et
Professeur Odile
Gelpi
(Hospices civils de Lyon), du comité national de
coordination de la recherche (CNCR)
•
Marie-Hélène
Mitjaville
, commissaire chargée du secteur recherche et
statistiques de la commission nationale de l'informatique et des
libertés (Cnil)
•
Frédérique Girard
,
président directeur général du laboratoire Dermscan, et
Noël Goupil,
conseiller technique de Facophar
Santé
•
Alain Grangé-Cabane
,
président, et
Docteur Anne Dux,
directeur des affaires
réglementaires et scientifiques de la fédération des
entreprises de la beauté (Febea)
•
Maître Soliman Le Bigot
,
vice-président, de la fédération nationale des unions des
jeunes avocats (FNUJA) et
Maître Thomas Roche
.
•
Claude Huriet
, sénateur,
président de l'Institut Curie
•
Catherine Lassale
, directeur des
affaires scientifiques, pharmaceutiques et médicales,
Claude
Bougé
, directeur général adjoint,
Claire
Sibenaler
, directeur études cliniques, environnement, et
Aline Bessis
, directeur en charge des affaires publiques des
entreprises du médicament (Leem)
•
Jean-Christophe Galloux
,
professeur de droit à l'Université Paris II
•
Anne-Sophie Ginon,
maître
de conférences, Université Paris Ouest Nanterre la
Défense
ANNEXE - PRÉSENTATION POWERPOINT DE L'EXAMEN DE LA PROPOSITION DE LOI RELATIVE AUX RECHERCHES SUR LA PERSONNE
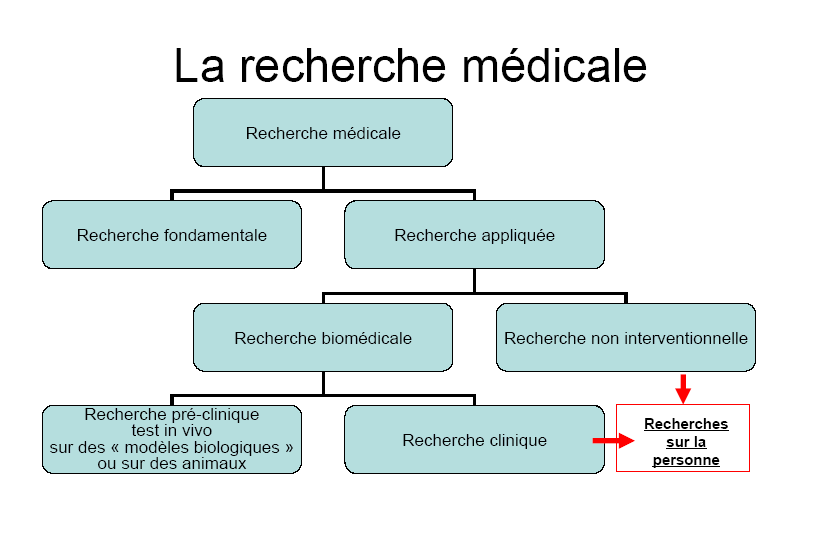
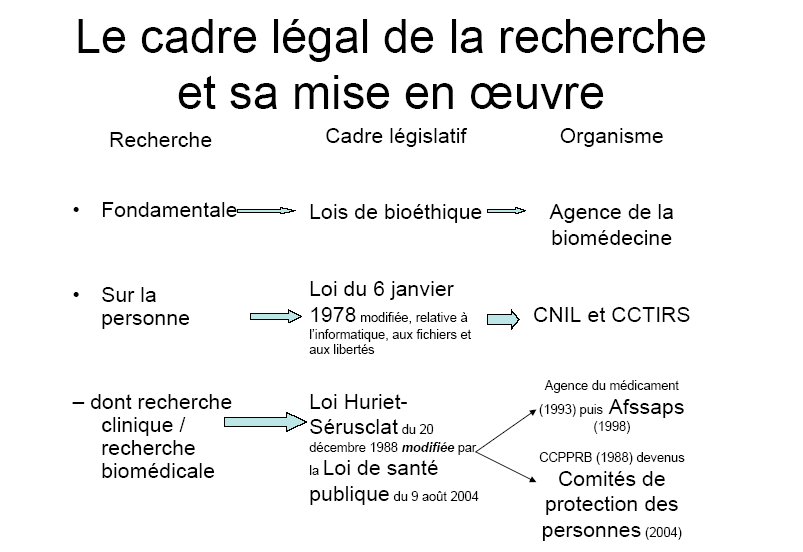
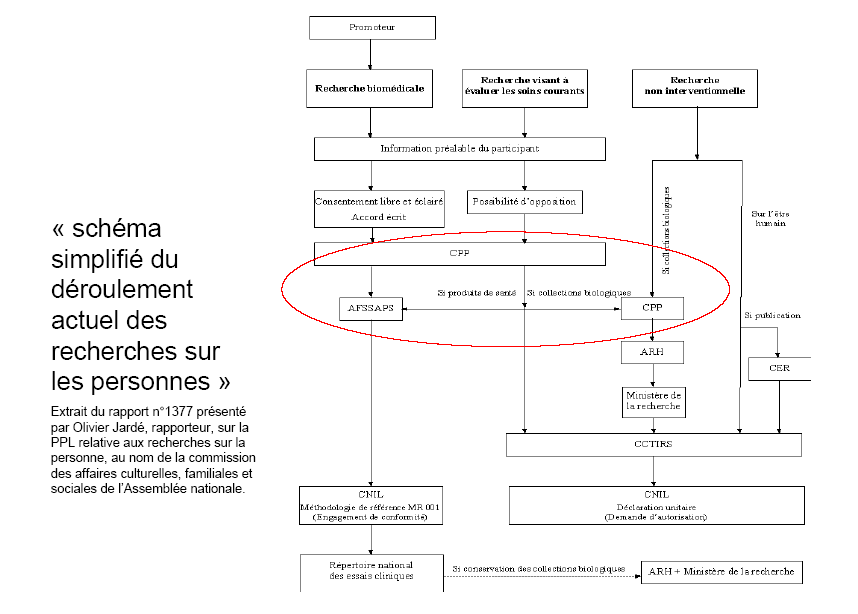

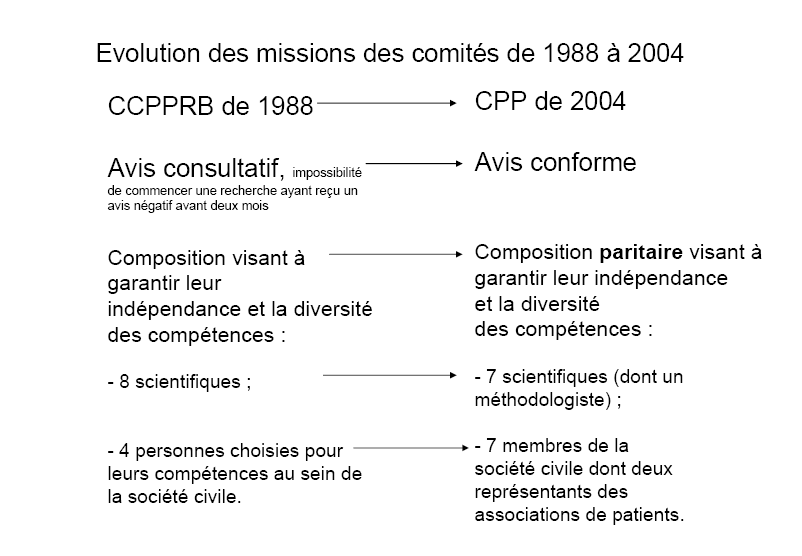
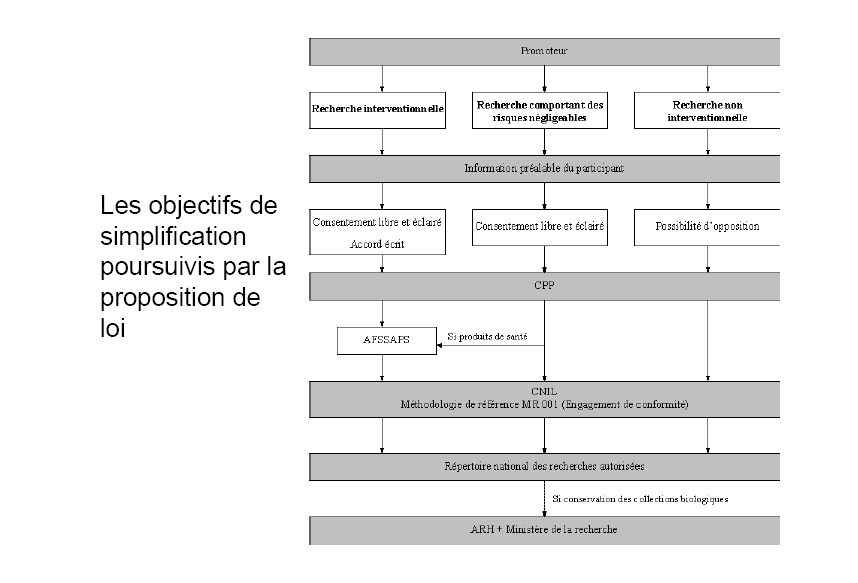
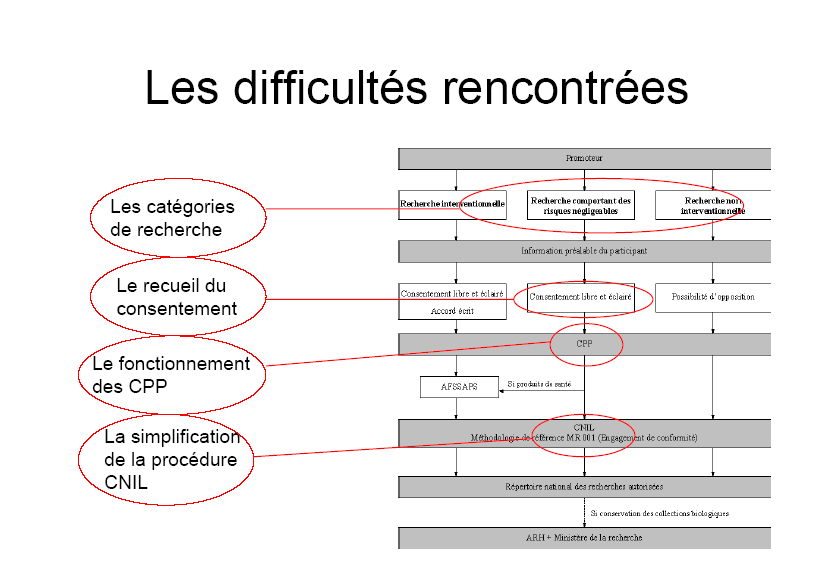
* 1 Françoise Alt-Maes, l'apport de la loi du 20 décembre 1988 à la théorie du consentement de la victime, Revue de science criminelle, 1991, p. 244.
* 2 Loi n° 88-1138 relative à la protection des personnes se prêtant à la recherche biomédicale.
* 3 Directives 65/65/CEE du Conseil, du 26 janvier 1965, concernant le rapprochement des dispositions législatives, réglementaires et administratives, relatives aux spécialités pharmaceutiques et 75/318/CEE du Conseil, du 20 mai 1975, relative au rapprochement des législations des Etats membres concernant les normes et protocoles analytiques, toxico-pharmacologiques et cliniques en matière d'essais de spécialités pharmaceutiques (spécialement la troisième partie relative aux essais cliniques).
* 4 Elle est aujourd'hui intégrée à l'agence française de sécurité sanitaire des produits de santé (Afssaps).
* 5 Loi n° 2004-806 du 9 août 2004, articles 88 et 89.
* 6 Lois n os 90-86 du 23 janvier 1990, 94-630 du 25 juillet 1994, 2002-303 du 4 mars 2002, 2004-801 du 6 août 2004, 2004-806 du 9 août 2004, 2006-450 du 18 avril 2006 et 2008-337 du 15 avril 2008.
* 7 Rapport d'information de Claude Huriet au nom de la commission des affaires sociales, Sénat n° 267 (2000-2001), le fonctionnement des comités consultatifs de protection des personnes dans la recherche biomédicale.
* 8 Décret n° 2006-477 du 26 avril 2006.
* 9 Trésor de la langue française, s.v.
* 10 Le sang de cordon : collecter pour chercher, soigner et guérir, rapport d'information établi au nom de la commission des affaires sociales, Sénat n° 79 (2008-2009).
* 11 Christiane Sinding, « Clinique », in Dictionnaire de la pensée médicale, sous la direction de Dominique Lecourt, Presses universitaires de France, 2004.
* 12 Avis aux promoteurs d'essais cliniques de dispositifs médicaux et dispositifs médicaux de diagnostic in vitro sur la mise en place et la conduite en France d'essais cliniques portant sur des dispositifs médicaux et dispositifs médicaux de diagnostic in vitro, 24 septembre 2008.
* 13 Charte du CNCR-CHU, 12 décembre 2005.
* 14 Cf. les recommandations de la mission d'information sur les conditions de mise sur le marché et de suivi des médicaments, rapport Sénat n° 382 (2005-2006) de Marie-Thérèse Hermange et Anne-Marie Payet, établi au nom de la commission des affaires sociales.
* 15 Danièle Cristol, la révision de la « loi Huriet » par la loi du 9 août 2004 relative à la politique de santé publique, revue de droit sanitaire et social, 2004, p. 285.
* 16 Avis n° 79, transposition en droit français de la directive européenne relative aux essais cliniques de médicaments : un nouveau cadre éthique pour la recherche sur l'homme, 18 septembre 2003.
* 17 Danièle Cristol, article précité.
* 18 Article 88 de la loi figurant désormais à l'article L. 1121-1, 2° du code de la santé publique.
* 19 Conformément à l'article 31 de la loi n° 2006-450 du 18 avril 2006 de programme pour la recherche, repris à l'article L. 1121-1 précité.
* 20 Anne-Sophie Ginon, la recherche en soins courants : une qualification hybride, revue de droit sanitaire et social, 2006, p. 1029.
* 21 Article L. 1121-1, 1°, du code de la santé publique.
* 22 Article L. 1121-4 du code de la santé publique.
* 23 Article R. 1123-4 du code de la santé publique.
* 24 Article R. 1123-4 du code de la santé publique.
* 25 Rapport d'information du Sénat n° 267 (2000-2001), précité.
* 26 Rapport n° 2005 125, la transformation des comités consultatifs de protection des personnes en matière de recherche biomédicale en comités de protection des personnes en application de la loi du 9 août 2004, présenté par Christine d'Autume, Bernadette Roussille et Pierre Aballea.
* 27 Article L. 1121-2 du code de la santé publique.
* 28 Loi n° 78-17 du 6 janvier 1978.
* 29 Notamment par le rapport de l'Igas, 2005, précité.
* 30 Le nom complet de ce traité est : Convention pour la protection des Droits de l'Homme et de la dignité de l'être humain à l'égard des applications de la biologie et de la médecine: Convention sur les Droits de l'Homme et la biomédecine.
* 31 Directive du Parlement européen et du Conseil du 4 avril 2001 concernant le rapprochement des dispositions législatives, réglementaires et administratives des États membres relatives à l'application de bonnes pratiques cliniques dans la conduite d'essais cliniques de médicaments à usage humain
* 32 Avis n°73 du 26 septembre 2002, Essais de phase I en cancérologie







