CHAPITRE
IV
ASSOUPLIR ET SIMPLIFIER
Article
38
Réforme des régimes d'accès dérogatoire aux
médicaments
Cet article propose une refonte globale des dispositifs actuels d'accès dérogatoire au médicament, en réorganisant l'autorisation temporaire d'utilisation (ATU) et la recommandation temporaire d'utilisation (RTU) autour de deux grandes nouvelles catégories d'accès : l'accès précoce et l'accès compassionnel.
La commission vous demande d'adopter cet article avec les modifications qu'elle a adoptées.
I - L'ATU et la RTU dessinent actuellement deux circuits dérogatoires d'accès au médicament, le premier au titre de l'accès précoce et le second au titre de la prescription hors AMM
A. L'ATU : l'accès précoce à des médicaments encore non-inscrits au remboursement
1. Un accès précoce largement défini
Le régime de l'autorisation temporaire d'utilisation (ATU), figurant à l'article L. 5121-12 du code de la santé publique (CSP), ouvre l'accès à certains médicaments qui ne sont pas encore bénéficiaires de l'autorisation de mise sur le marché (AMM) mais dont l'utilisation, dans des indications thérapeutiques précises, peut traiter des maladies graves ou rares pour lesquelles aucun traitement approprié n'est encore identifié .
On en dénombre deux types, dont les objectifs sont fondamentalement distincts :
- les ATU de cohorte (ATUc), accordées lorsque l'efficacité du médicament visé est fortement présumée au vu d' essais thérapeutiques conduits et réalisés par l'exploitant et que ce dernier est déjà engagé (ou s'engage à l'être) dans une démarche d'obtention de l'AMM ;
- les ATU nominatives (ATUn), dont le régime a été récemment précisé et encadré par la loi de financement de la sécurité sociale (LFSS) pour 2020, permettant la prescription individuelle et sous conditions par un médecin d'un médicament n'étant pas titulaire d'AMM lorsque son efficacité est fortement présumée et que l'état du patient bénéficiaire l'expose à des conséquences graves en l'état des thérapeutiques disponibles.
Les ATU sont délivrées par l'agence nationale de sécurité du médicament et des produits de santé (ANSM), à la demande de l'exploitant dans le cas des ATUc ou du médecin prescripteur dans le cas d'une ATUn.
Cette délivrance est normalement subordonnée à la conclusion entre l'ANSM et l'exploitant d'un protocole d'utilisation thérapeutique (PUT) prévoyant le recueil d'informations visant à objectiver l' efficacité , les effets indésirables et les conditions réelles d'utilisation du médicament autorisé.
2. Une couverture par l'assurance maladie conditionnée à des remboursements rétroactifs par l'exploitant
L'accès précoce aux médicaments bénéficiaires d'ATU intervenant bien en amont de leur éventuelle inscription sur la liste des spécialités remboursables par l'assurance maladie , laquelle n'est décidée qu'à l'issue de l'obtention de l'AMM et d'une phase de négociation intégrant l'exploitant, la Haute Autorité de santé (HAS) et le comité économique des produits de santé (CEPS), la prise en charge financière des spécialités faisant l'objet d'une autorisation dérogatoire a dû faire l'objet d'un régime spécifique , décrit aux articles L. 162-16-5 et L. 162-16-5-1 du code de la sécurité sociale (CSS).
Dans le cas d'un médicament réellement innovant, c'est-à-dire dont les effets thérapeutiques dans une indication thérapeutique considérée n'a pas encore fait l'objet d'une évaluation de service médical rendu (SMR), le laboratoire communique au CEPS le montant de l' indemnité maximale qu'il réclame aux établissements de santé, uniques distributeurs des médicaments sous ATU 190 ( * ) .
Cette indemnité lui est alors versée par l'assurance-maladie , dans la limite d'un montant de 10 000 euros par patient et par an, cette limite ne s'appliquant qu'aux laboratoires réalisant, à raison de ces médicaments, un chiffre d'affaires supérieur à 30 millions d'euros par an.
À l'issue de la phase d'inscription sur la liste des spécialités remboursables, si le prix net de référence d'une spécialité, calculé par le CEPS sur la base des prévisions de ventes sur trois ans et diminué des remises négociées avec l'exploitant, est inférieur au montant de l'indemnité réclamée à l'initiation du circuit ATU, le laboratoire est contraint de reverser à l'assurance-maladie , sous forme de remises (dites « remises ATU »), la différence entre le chiffre d'affaires facturé aux établissements de santé et celui qui aurait résulté de la valorisation des unités vendues au prix net de référence.
Se dessine donc un cadre juridique dual, qui fait se succéder, pour un médicament pris isolément , une phase d' accès précoce , étroitement réglementée par l'ANSM et durant laquelle la couverture financière du traitement est assurée par l'assurance maladie sans négociation avec l'exploitant, et une phase d' accès de droit commun , à partir de laquelle le médicament n'est plus délivré que sous son prix défini par le CEPS après négociation. L'ajustement financier, en cas de déséquilibre entre ces deux phases, est assuré par un versement compensatoire de l'exploitant à l'assurance maladie, apparentant ainsi la période d'ATU à un simple mécanisme d' avance sur trésorerie .
Le montant global des remboursements par l'assurance maladie et des remises reversées par les laboratoires est retracé dans le tableau ci-dessous. Le montant exceptionnellement élevé des remises pour les ATU et post-ATU clôturées en 2019 est lié à quelques produits spécifiques.
|
2017 |
2018 |
2019 |
|
|
Montants remboursés par l'assurance maladie pour les médicaments sous ATU et post-ATU (en millions d'euros) |
757 |
856 |
789 |
|
Montant des remises ATU et post-ATU (en millions d'euros) |
158 |
177 |
638 |
Source : DGOS
3. La restriction de l'accès précoce durant la phase « post-ATU » et l'apport de la LFSS pour 2019
Deux difficultés sont successivement apparues dans la juxtaposition de ces deux phases.
En premier lieu, la fin du dispositif de l'ATU étant juridiquement marquée par l'entrée en vigueur de l'AMM , et non par l'inscription à la liste des spécialités remboursables par le CEPS, s'est posé le problème de la continuité financière de la prise en charge entre l'extinction de l'ATU et la détermination d'un prix net de référence, délai pouvant aller jusqu'à plusieurs mois .
Cette période intermédiaire, qualifiée de « post-ATU », a fait l'objet d'aménagements spécifiques : jusqu'en 2019, l'article L. 162-16-5-2 du CSS prévoyait ainsi qu'un médicament ayant bénéficié d'une ATU et désormais titulaire d'une AMM pouvait, dans l'attente de la fixation de son prix net de référence, continuer d'être totalement pris en charge par l'assurance maladie, à la condition que l'indication thérapeutique visée figure bel et bien dans son dossier d'AMM . Concrètement, la phase de « post-ATU » bénéficiait de la même couverture financière que la phase ATU, mais pour un périmètre d'indication thérapeutique désormais figé : celui de l'AMM.
C'est ici qu'apparaissait la seconde difficulté, doublée d'un paradoxe : bien que le médicament en post-ATU fût encore régi par le droit de l'accès précoce (qui, par définition, n'a pas encore rigoureusement identifié toutes les indications thérapeutiques pour lesquelles ce médicament pourrait être efficace), ne pouvaient être pris en charge durant cette période par l'assurance-maladie que des patients répondant aux indications thérapeutiques contenues dans l'AMM (qui, obligatoirement fondées sur des essais cliniques déjà réalisés et conclusifs, sont par définition plus restreintes que celles de l'ATU).
Nos collègues Yves Daudigny, Catherine Deroche et Véronique Guillotin, dans un rapport qui a fait date 191 ( * ) , avaient relevé l'inexplicable perte de chances à laquelle ce hiatus juridique et financier exposait les patients intégrés au circuit au cours de la phase post-ATU qui, en contradiction manifeste du modèle de l'accès précoce, ne pouvaient désormais y entrer qu'à raison de certaines pathologies définies.
Cette difficulté a depuis été résolue par la LFSS pour 2019 192 ( * ) , qui a permis, au bénéfice des seules ATU et post-ATU de cohorte, d'élargir la prise en charge précoce aux extensions d'indication après obtention de l'AMM .
4. Des difficultés de méthode posées par le remboursement rétroactif par le laboratoire
Aux termes du rapport précité de nos collègues, les laboratoires continuent néanmoins de déplorer le caractère excessivement complexe et peu adapté du mode de financement de l'accès précoce en dénonçant notamment :
- le mécanisme de plafonnement de l'indemnité à 10 000 euros annuels par patient, dont les industriels estiment qu'il n'est pas du tout adapté aux nouvelles thérapies anticancéreuses ;
- le mode de calcul de la remise à verser par le laboratoire à l'issue de la phase post-ATU, qui s'appuie sur le prévisionnel de ventes sur trois ans , une donnée par nature incertaine et soumise à de nombreux aléas. Ce mode de calcul est décrit comme particulièrement périlleux pour les laboratoires de petite taille, dont les prévisionnels de vente sont davantage exposés à la concurrence, et qui peuvent se voir imposer des montants de remise calculés sur des bases surestimées.
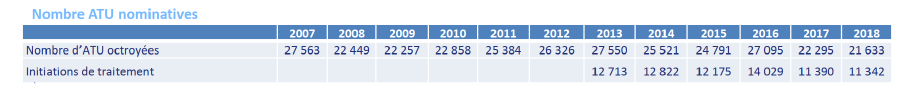
5. La restriction progressive de l'ATU nominative, dite « compassionnelle »
Bien que relevant initialement du même régime juridique que les ATU de cohorte, les ATU nominatives se sont progressivement éloignées de l'épure de l'accès précoce pour s'apparenter davantage à des traitements « compassionnels », certes prescrits par un médecin en considération d'une balance avantages-risques, mais dont l'effet bénéfique ne peut toutefois se déduire d'un essai clinique.
Stable jusqu'en 2016, le nombre d'ATU nominatives accordées connaît depuis cette date un repli régulier , en grande partie causé par un durcissement législatif des conditions d'accès .
Source : Rapport de l'ANSM
Ce dernier s'est d'abord manifesté par l'impossibilité pour un patient d'être pris en charge au titre d'une ATU nominative pour un médicament à partir du moment où ce dernier a obtenu l'AMM 193 ( * ) . Autrement dit, à compter de cette obtention, il n'est plus possible pour un traitement d'étendre le champ de ses bénéficiaires à titre compassionnel.
Mais l'inflexion a été particulièrement sensible lors de l'examen de la LFSS pour 2020 194 ( * ) , dont l'article 44 a introduit une double limitation :
- le nombre total d'ATU nominatives par médicament pourra désormais être plafonné par arrêté ministériel ;
- l'interdiction faite à un médicament de bénéficier d'une ATU nominative s'il dispose déjà d'une première AMM, indépendamment de l'indication pour laquelle la demande d'ATU est effectuée.
B. La RTU : la prescription de médicaments titulaires de l'AMM mais pour une autre indication thérapeutique
Décrite à l'article L. 5121-12-1 du CSP, la recommandation temporaire d'utilisation (RTU) , lorsqu'elle est établie par l'ANSM, permet à un médecin de prescrire une spécialité pharmaceutique pour une indication thérapeutique non conforme à son AMM.
Bien que proche dans sa dénomination de l'ATU, la RTU remplit des missions sensiblement différentes en ce qu' elle ne vise pas des médicaments innovants (non titulaires d'AMM), mais des médicaments déjà autorisés pouvant, en l'absence de spécialité similaire ou d'alternative médicamenteuse, servir à d'autres indications thérapeutiques que celles définies par leur AMM.
Les RTU sont également assorties d'un protocole de suivi des patients, dont les formes et le contenu sont similaires à celui requis pour les ATU.
L'article L. 162-17-2-1 du CSS indique qu'un arrêté ministériel peut prévoir leur prise en charge par l'assurance maladie, à plusieurs conditions :
- en premier lieu, le médicament n'y est éligible que si son utilisation est indispensable à l'amélioration de l'état de santé du patient ;
- en outre, l'arrêté peut comporter l'obligation pour le laboratoire de déposer, pour l'indication considérée, une demande d'AMM ou une demande d'inscription au remboursement ;
- enfin, si la spécialité en question ne fait l'objet, pour ses indications au titre de son AMM, d'aucune inscription au remboursement, sa prise en charge au titre de sa RTU est limitée par une base forfaitaire annuelle par patient fixée par décision ministérielle, après avis de l'union nationale des caisses d'assurance maladie (Uncam).
II - L'article 38 du présent projet de loi réorganise profondément les circuits de l'accès dérogatoire aux médicaments, en les distinguant selon leur finalité
L'article 38 entend rationaliser des circuits d'accès dérogatoire, dont l'empilement pose aujourd'hui d'importants problèmes de lisibilité. Il tente une clarification de ces circuits en les réorganisant non plus d'après leur seule dénomination, comme c'est actuellement le cas, mais d'après leur finalité dans le traitement du patient .
A. La réunion de l'ATU et de la RTU sous trois régimes juridiques de l'accès dérogatoire, distinguant accès précoce, accès compassionnel et prescription « hors AMM »
Le 2° du I de l'article 38 du présent projet de loi procède à la réécriture complète des articles régissant actuellement l'attribution de l'ATU et de la RTU, en y substituant deux nouvelles voies d'accès dérogatoire au médicament : l'accès précoce et l'accès compassionnel.
1. Une redéfinition profonde de l'ATU de cohorte, renommée autorisation d'accès précoce (nouvel article L. 5121-12)
Est proposé un nouvel l'article L. 5121-12 , qui définit l' accès « précoce » comme « l'utilisation, à titre exceptionnel, de certains médicaments, dans des indications thérapeutiques précises, destinés à traiter des maladies, rares ou invalidantes ». Les conditions d'attribution de l'autorisation d'accès précoce (AAP) reprennent celles de l'ATU (absence de traitement approprié, caractère urgent de la mise en oeuvre du traitement, forte présomption d'efficacité au vu de résultat d'essais cliniques) en ajoutant toutefois que, pour en bénéficier, le médicament doit être présumé innovant, « notamment au regard d'un éventuel comparateur cliniquement pertinent ».
L'accès à l'AAP reste reconnu, sur le modèle de l'ATU, aux médicaments ne disposant pas de l'AMM dans une indication considérée mais pour laquelle l'exploitant a déjà déposé un dossier d'obtention.
Il est également élargi aux médicaments qui disposent déjà d'une AMM pour une indication particulière, mais qui ne bénéficient pas de l'inscription sur la liste des spécialités remboursables pour cette indication. Il s'agit concrètement de consacrer l'intégration, en droit commun, du régime actuel du post-ATU à l'accès précoce proprement dit . Pour ces médicaments particuliers, l'application du régime de l'accès précoce ne vaudrait que si l'entreprise a déposé, ou s'est engagée à déposer une demande d'inscription au remboursement dans un délai d'un mois suivant l'obtention de l'AMM .
Contrairement au droit existant, qui en faisait la compétence exclusive de l'ANSM, l'AAP serait accordée par la Haute Autorité de santé (HAS) , après avis conforme de l'ANSM, et uniquement sur demande de l'entreprise intéressée. Les modalités d'attribution de l'actuelle ATU nominative (sur prescription médicale) ne sont donc pas retenues pour l'AAP.
Le périmètre de l'autorisation, conformément aux apports de la LFSS pour 2019, reste l' indication thérapeutique considérée .
Est par ailleurs maintenue l'obligation pour l'entreprise exploitante de produire un PUT , dont le texte précise explicitement qu'il serait défini par la HAS (et annexé à la décision d'autorisation) et que sa mise en oeuvre se fera à la charge exclusive de l'exploitant. Ces dispositions visent manifestement à rendre cette obligation de suivi plus effective , le rapport précité de nos collègues ayant signalé que ce dernier pouvait être souvent « lacunaire ou de médiocre qualité ».
Le nouvel article précise par ailleurs les conditions matérielles de la prescription d'un médicament délivré sous le régime de l'AAP, en prévoyant qu'en apparaisse la mention manuscrite sur l'ordonnance.
Il énonce enfin les cas dans lesquels deux autorités peuvent prononcer la suspension ou le retrait de l'AAP . La HAS pourra y recourir lorsque le cadre juridique décrit par le présent article ne sera pas respecté par l'exploitant ou lorsque ce dernier ne se conformera pas à l'obligation de déposer une demande d'AMM. L' ANSM pourra par ailleurs en formuler la demande pour des motifs de santé publique ou si l'examen des données produites dans le cadre du PUT montre une détérioration de la présomption d'efficacité. Pour ces motifs, et en cas d'urgence, elle pourra directement se substituer à l'HAS dans l'exercice de cette prérogative.
Enfin, le 4° du II de l'article 38 consacre au code de la sécurité sociale la nouvelle mission d'octroi des autorisations d'accès précoce qu'attribue l'article à la HAS . Cette intervention de la HAS, chargée par ailleurs de l'évaluation du service médical rendu (SMR) des médicaments bénéficiaires d'une AMM, dans le circuit de l'accès dérogatoire dénote une volonté d'en renforcer l'encadrement et de mieux contrôler dès le dépôt de la demande la présomption d'efficacité du médicament .
Qualifié de « malthusien » par les représentants des industriels, ce nouveau mode d'autorisation vise à limiter les interruptions de parcours de spécialités qui, autorisées par l'ANSM, voient leur demande d'inscription au remboursement rejetées par la HAS alors que le circuit d'accès précoce est déjà pleinement entamé.
2. L'introduction d'un régime d'accès compassionnel (nouvel article L. 5121-12-1)
Le nouvel article L. 5121-12-1 introduit pour la première fois la possibilité d'une « utilisation exceptionnelle, au titre de l' accès compassionnel , de certains médicaments », lorsqu'il n'existe aucun traitement approprié dans l'indication considérée et lorsque le médicament visé voit son efficacité et sa sécurité présumées et ne fait pas l'objet d'une recherche impliquant la personne humaine.
L'autorisation d'accès compassionnel (AAC) peut alors être attribuée selon deux modalités de demande :
- à la demande d'un médecin prescripteur , l'ANSM pourrait autoriser, au bénéfice d'un patient nommément désigné, l'utilisation compassionnelle d'un médicament ne disposant pas d'AMM dans aucune indication thérapeutique ou d'un médicament disposant d'une AMM dans une autre indication que celle considérée, à la condition d'avoir fait l'objet d'un arrêt de commercialisation. Lorsque l'urgence le justifie, il peut être dérogé à la condition d'absence de toute recherche impliquant la personne humaine, à la condition que l'exploitant s'engage à déposer une demande d'AAP 195 ( * ) : il ne s'agirait dans ce cas-là pas tant de fournir un accès compassionnel que d'assurer, en raison de l'urgence, un traitement en amont même de la phase d'accès précoce ;
- à la demande directe du ministre de la santé ou de l'ANSM , auquel cas l'AAC prendrait alors le nom de « cadre de prescription compassionnelle » et ne pourrait alors concerner qu'un médicament faisant déjà l'objet d'une AMM, mais uniquement pour d'autres indications que celle considérée.
Par ailleurs, l'AAC n'étant pas délivrée sur demande de l'exploitant, le nouvel article L. 5121-12-1 prévoit son information lors de son attribution. Il signale également la même obligation incombant à l'exploitant d'établissement d'un PUT , à la nuance près que cette obligation ne s'applique pas, dans le cas d'un cadre de prescription compassionnelle, s'il existe « suffisamment de recul sur les conditions d'utilisation de la spécialité » ou s'il existe « une autre spécialité comparable disposant d'une AMM dans cette indication ».
L'article mentionne enfin l'obligation faite au prescripteur d'informer le patient des modalités d'accès au médicament sous AAC, et de motiver sa prescription, ainsi que la possibilité laissée à l'ANSM (seulement) de suspendre ou de retirer toute AAC pour motifs de santé publique ou si le cadre juridique défini par le nouvel article L. 5121-12-1 n'est plus respecté.
3. Un nouveau régime éclaté de la prescription « hors AMM »
Aux termes de l'article 38 du présent projet de loi, le régime actuel de la RTU, concentré à l'article L. 5121-12-1 du CSP et définissant l'encadrement d'un médicament déjà titulaire de l'AMM pour une autre indication que la sienne (le « hors AMM ») , se trouverait désormais éclaté entre les trois nouveaux régimes de l'accès précoce, de l'accès compassionnel et de la prescription « hors AMM » proprement dite.
Comme précédemment indiqué, relèverait désormais de la procédure d'accès précoce la prescription « hors AMM » d'un médicament déjà titulaire d'une AMM pour une autre indication que celle considérée, et non inscrit au remboursement au titre de cette dernière . Par rapport à la RTU, cette possibilité de recourir au « hors AMM » pour ce cas précis se trouverait considérablement durcie par la procédure d'AAP, bien plus contraignante.
Par ailleurs, aux termes du nouvel article L. 5121-12-1, l'essentiel des cas de prescription « hors AMM » se limiterait dorénavant aux cadres de prescription compassionnelle . L'ancienne RTU en sortirait profondément modifiée qui, d'outil thérapeutique mis à disposition du médecin pour le traitement d'un patient particulier en appréciation de ses besoins, ne relèverait désormais plus que de strictes fins compassionnelles.
Enfin, un nouvel article L. 5121-12-2 précise toutefois qu'en dehors du cadre de prescription compassionnelle, une spécialité pourra faire l'objet d'une prescription « hors AMM » aux conditions qu'aucune alternative thérapeutique ne soit disponible et que le prescripteur juge le recours à cette spécialité indispensable pour améliorer l'état clinique de son patient. Les mêmes obligations d'information du patient et de motivation de la décision seraient alors applicables.
En résumé, l'article 38 entend mettre fin à la prescription « hors AMM » comme régime uniforme et distinct, et la repositionner comme simple modalité de l'accès précoce ou de l'accès compassionnel .
4. De nouveaux régimes juridiques qui s'accompagnent de précisions
Outre l'instauration de ces trois nouveaux régimes, l'article 38 comporte plusieurs dispositions visant à préciser leur circuit de distribution et à renforcer certaines obligations découlant de l'accès dérogatoire.
Le 5° du I précise le renvoi à un décret en Conseil d'État, où sont déterminées les modalités de présentation, d'octroi, de modification, de suspension et de retrait de toute autorisation d'accès précoce ou d'accès compassionnel.
Le 8° du I indique que lorsqu'un médicament bénéficie d'une AAP ou d'une AAC sans pour autant figurer explicitement parmi les médicaments de la rétrocession hospitalière , il est néanmoins réputé inscrit sur la liste que les pharmacies à usage intérieur (PUI) des établissements de santé sont autorisées à dispenser au public.
Le 9° du I redéfinit le manquement soumis à sanction financière que constitue le fait pour tout exploitant de ne pas recueillir et de ne pas transmettre aux autorités sanitaires les PUT et recueils de données requis en cas d'AAP ou d'AAC.
Les 1°, 3°, 4°, 6°, 7°, 10°, 11° et 12° du I procèdent à des coordinations, essentiellement consécutives du changement de dénomination.
5. Une disposition incidente sur les ruptures de médicaments
Par ailleurs, le 6° du I élargit le périmètre des médicaments pour être achetés, fournis et pris en charge par des établissements publics sans pour autant figurer sur la liste des médicaments agréés aux « médicaments bénéficiant d'une autorisation d'importation dans le cadre d'une rupture de stock, d'un risque de rupture ou d'un arrêt de commercialisation ».
B. Un régime de prise en charge financière de l'accès dérogatoire aux médicaments intégralement remanié
Sans remettre en cause le principe d'une prise en charge financière par l'assurance maladie des médicaments bénéficiant d'un accès dérogatoire, le présent article 38 redéfinit en profondeur les modalités et le circuit de leur financement.
1. Une prise en charge de l'accès précoce qui tient toujours compte des indications hors périmètre de l'AMM
Le 6° du II crée un nouvel article L. 162-16-5-1 du CSS confirmant que la prise en charge d'un médicament bénéficiaire d'une AAP ne vise plus le médicament pris en soi, mais l'indication considérée . Il est en effet spécifié que « la prise en charge prend fin lorsque cette indication est inscrite, au titre de son AMM » sur l'une des listes des spécialités remboursables.
On peut donc en déduire qu'un même médicament, devenu bénéficiaire d'une AMM pour une indication spécifique déterminée par l'exploitant au moment du dépôt de la demande d'AAP, peut continuer à être pris en charge au titre de l'accès précoce pour les autres indications thérapeutiques mentionnées à l'entrée dans la phase d'accès précoce et n'ayant pas encore fait l'objet d'une AMM.
Les autres dispositions de ce nouvel article définissent les cas d'interruption de prise en charge (retrait de l'AAP, refus d'inscription sur une liste de spécialités remboursables, retrait de la demande d'AMM ou de la demande de remboursement).
Elles précisent également que, dans le cas de prise en charge d'une indication sous le régime de l'AAP, le ministère de la santé peut modifier par arrêté les conditions de dispensation de toute autre spécialité déjà bénéficiaire d'une AMM (vraisemblablement pour la même indication, ce que le texte ne mentionne pas).
2. Un circuit de financement de l'accès précoce simplifié pour l'exploitant
a) Avant l'inscription au remboursement
Les modalités de prise en charge financière font l'objet d'un nouvel article L. 162-16-5-1-1 du CSS, qui reprend le principe de libre fixation d'une indemnité maximale par l'exploitant 196 ( * ) , versée par l'assurance maladie .
Ce nouvel article ne retient pas le mécanisme actuel de plafonnement de l'indemnité (10 000 euros par patient si l'exploitant réalise un chiffre d'affaires supérieur à 30 millions d'euros), mais lui substitue, pour chaque indication thérapeutique considérée, un mécanisme de versement de remises calculées sur la base du chiffre d'affaires facturé aux établissements de santé au titre de ladite indication .
Ces remises seront établies en fonction d'un barème progressif fixé par arrêté, introduisant ainsi le principe d'une contribution de l'exploitant définie à raison du chiffre d'affaires qu'il dégage et mettant fin aux biais d'imprévisibilité du dispositif précédent, fondé sur le prévisionnel de vente à trois ans .
Ces taux de remises pourront éventuellement être majorés dans plusieurs cas :
- si l'exploitant n'a pas déposé de demande d'AMM dans un délai préfix ;
- si aucun prix n'a été fixé à l'issue d'un délai de 180 jours après la demande d'inscription au remboursement ;
- si une autre spécialité identifiée par la HAS comme répondant au besoin thérapeutique visé a été inscrite au remboursement ;
- si, pour l'indication thérapeutique considérée, la HAS remet en cause, au moment de la demande d'inscription au remboursement, la présomption d'innovation du médicament.
b) À partir de l'inscription au remboursement
Lorsque le médicament est admis au remboursement, le nouvel article L. 162-15-5-1-1 indique que la négociation de son prix net de référence doit inclure le montant d'une restitution ou d'une remise supplémentaire , égal à la différence entre le chiffre d'affaires facturé aux établissements de santé pendant la période d'accès précoce (déduction faite des remises consenties sur l'indemnité maximale) et le chiffre d'affaires qui aurait résulté de l'application du prix net de référence.
L'article introduit le cas où cette différence se révèlerait à l'avantage du laboratoire (prix net de référence supérieur à l'indemnité maximale), à qui serait alors restitué ce montant, dans la limite toutefois de la remise consentie sur l'indemnité.
3. La contrepartie de la prise en charge de l'accès précoce : la continuité du traitement
Le 8° du II adapte à l'accès précoce l'obligation pour le laboratoire d'assurer la continuité des traitements initiés. Cette continuité doit être assurée pendant toute la prise en charge, puis, à l'issue de la prise en charge, pendant une période dont la durée ne peut dépasser un an. La condition de continuité ne s'applique bien sûr pas si la spécialité fait l'objet d'un arrêt de commercialisation pour des raisons de sécurité.
La période de continuité fait également l'objet d'une couverture financière par l'assurance maladie, avec versement rétroactif d'une remise par le laboratoire si son chiffre d'affaires facturé aux établissements de santé au titre de cette période est supérieur à celui qui aurait résulté de la valorisation de ses unités au prix net de référence.
4. Un régime de prise en charge distinct pour l'accès compassionnel
Alors que le droit existant jumelait les régimes de prise en charge des ATU de cohorte et des ATU nominatives, le présent article 38 crée un nouvel article L. 162-16-5-2 du CSS spécifique au financement de l'accès compassionnel.
Le principe d'une prise en charge par l'assurance maladie est maintenu, soit dans les conditions de droit commun si le médicament est déjà inscrit au remboursement pour une autre indication, soit selon l'indemnité maximale réclamée par l'exploitant. Peut être également définie une base forfaitaire annuelle par patient par arrêté ministériel.
Si la prise en charge obéit au régime de l'indemnité maximale, un mécanisme similaire au régime de l'AAC de versement de remises selon un barème progressif s'applique.
Le nouvel article traite par ailleurs du cas particulier, évoqué au nouvel article L. 5121-12-1 du CSP, d'un médicament bénéficiaire d'une AAC et dont l'exploitant, ayant engagé des recherches sur la personne humaine, s'est engagé à déposer une demande d'AAP. Dans ce cas, un décret en Conseil d'État précise les conditions dans lesquelles les remises peuvent être majorées si la demande d'AAP n'est pas déposée dans le délai préfix ou si le nombre d'autorisations d'accès compassionnel demandé pour ce médicament excède un seuil défini par arrêté.
Plusieurs conditions, définies par arrêté, peuvent également s'imposer à la prise en charge d'une AAC par l'assurance maladie (dépôt d'une demande d'AMM, respect des procédures indiquées au sein du PUT), dont le non-respect exposerait l'exploitant au paiement d'une sanction financière.
L'article évoque ensuite les différents cas d'interruption de la prise en charge : retrait ou suspension de l'AAC ou du cadre de prescription compassionnelle, attribution d'une AAP, inscription de la spécialité au remboursement, identification par la HAS d'une alternative thérapeutique inscrite au remboursement. Réciproquement, l'article précise les deux cas où la prise en charge peut être maintenue après que l'AAC a cessé de produire ses effets (lorsque l'AMM a été délivrée) : lorsque l'indication est mentionnée dans l'AMM sans que cette dernière n'ait conduit à l'inscription au remboursement et lorsque la continuité du traitement d'un patient donné le requiert, sous réserve que l'indication n'ait pas fait l'objet d'une évaluation défavorable au titre de l'AMM.
Les 1°, 2°, 3°, 5°, 7°, 9°, 11°, 12°, 13° et 15° du II , ainsi que le III procèdent à des coordinations, essentiellement consécutives du changement de dénomination.
C. Autres dispositions et entrée en vigueur
Le 10° du II opère une coordination actant la suppression du régime de la RTU.
Le 14° du II, une fois le texte entré en vigueur, retirerait à l'union nationale des caisses d'assurance maladie (Uncam) la mission de rendre un avis sur le montant de la base forfaitaire annuelle retenue par le ministre de la santé pour financer un dispositif médical non inscrit sur la liste des prestations et produits remboursables (LPPR) mais jugé néanmoins indispensable au suivi thérapeutique d'un patient par son prescripteur. Cette disposition, sans doute issue d'une erreur de coordination, mériterait d'être corrigée.
Le A du IV prévoit un entrée en vigueur générale du dispositif à une date fixée par décret ne pouvant aller au-delà du 1 er juillet 2021.
Le B du IV prévoit l'application du droit actuel à toutes les ATU délivrées antérieurement au présent projet de loi jusqu'à leur terme. À cette date, leur sera ouverte la possibilité d'être renouvelée sous la forme d'une AAP ou d'une AAC.
Le C du IV assure la prise en charge financière, une fois le texte entré en vigueur, des spécialités entrées dans leur phase « post-ATU ».
Le D du IV consacre la conversion des RTU en AAC à compter de l'entrée en vigueur du texte.
Enfin, le E du IV prévoit que pour une durée ne pouvant aller au-delà du 1 er janvier 2023, les remises dues par les laboratoires au titre d'une AAC seront calculées sur la base d'une fraction de leur chiffre d'affaires réalisé pour cette spécialité ne pouvant dépasser 10 %.
III - Une réforme ambitieuse globalement bien perçue des parlementaires, dont ils espèrent qu'elle stabilisera enfin le droit de l'accès dérogatoire aux médicaments
A. Les modifications à la marge apportées par l'Assemblée nationale
Outre seize amendements rédactionnels du rapporteur général de la commission des affaires sociales, l'Assemblée nationale a adopté trois amendements de précision ou de simplification du dispositif :
- un premier amendement, déposé en termes identiques par le rapporteur général et par Mme Stéphanie Rist, précise la prise en charge financière des médicaments faisant l'objet d'une continuité de traitement après leur sortie de l'accès précoce , en indiquant que la prise en charge par l'assurance maladie obéit aux modalités de droit commun dès lors que la spécialité en question est admise au remboursement . Dans le cas contraire, la prise en charge dérogatoire peut être maintenue, pour une durée n'excédant pas un an ;
- un deuxième amendement, déposé par le rapporteur général, vise à simplifier les modalités de suivi du patient admis à l'accès compassionnel par son prescripteur ;
- un dernier amendement, déposé en termes identiques par le rapporteur général, Mme Agnès Firmin Le Bodo et M. Paul Christophe, introduit une demande de rapport au Parlement sur l'impact de la réforme portée par l'article 38.
B. Votre commission globalement favorable à l'adoption de cet article malgré quelques ajustements
Selon les termes même des représentants des industriels et laboratoires auditionnés par votre rapporteure, « la réforme proposée apparaît globalement équilibrée et conforme aux travaux menés entre les entreprises du médicament et l'administration au cours de ces derniers mois ».
Prolongeant la tendance ininterrompue des PLFSS à modifier par touches le régime de l'accès dérogatoire, au point de menacer sérieusement l'attractivité et la stabilité du modèle français, cette réforme systémique se présente comme une tabula rasa nécessaire et opportune, aussi attendue des acteurs du secteur que des parlementaires.
Certains problèmes « d'applicabilité » ont néanmoins été soulevés par les acteurs du médicament, qui dénotent le caractère encore inabouti de la réforme.
1. Le délai d'inscription au remboursement dans le cas d'un médicament en phase « post-ATU »
Bien qu'il faille saluer l'intégration dans le droit commun de l'accès précoce de la phase « post-ATU », qui demeurait jusqu'alors exposée à quelques insécurités, votre rapporteure n'estime pas opportun qu'un délai d'un mois soit imposé au laboratoire , pour bénéficier du régime de l'accès précoce, entre l'obtention de l'AMM et la demande d'inscription au remboursement.
En effet, comme les représentants des industriels l'ont rappelé en audition, l'attribution souvent très précoce de l'AMM par l'agence européenne du médicament (EMA) contraindrait alors le laboratoire à formuler une demande d'inscription au remboursement dans un délai d'un mois suivant cette obtention, alors qu'il ne dispose alors que de très peu de données sur les effets réels de la spécialité, ce qui serait susceptible d'orienter l'avis de la commission de la transparence de la HAS vers un service médical rendu « dégradé ».
Aussi, la commission a adopté, sur proposition de votre rapporteure, un amendement n° 179 visant à permettre un dépassement de ce délai.
2. Le refus de la HAS d'accorder une autorisation d'accès précoce
L'absence de motivation du refus de la HAS d'accorder une autorisation d'accès précoce nuit à la transparence du nouveau dispositif.
La commission des affaires sociales a donc adopté, sur proposition de votre rapporteure, un amendement n° 180 palliant cette lacune.
3. Le cas de majoration de remise en cas de dépassement d'un délai de 180 jours pour l'inscription au remboursement d'un médicament sous accès précoce
L'application d'une majoration de remise sur l'indemnité d'accès dérogatoire pour l'industriel dans le cas où un délai de 180 jours serait dépassé entre le dépôt de demande de remboursement et l'inscription au remboursement pose un double problème.
D'une part, en application d'une directive européenne et de l'article R. 163-9 du CSS qui la transpose, ce délai de 180 jours a été défini pour s'imposer aux pouvoirs publics dans l'inscription au remboursement des médicaments de droit commun , sans être pour autant respecté du fait de délais de traitement particulièrement longs de la commission de transparence de la HAS (132 jours en moyenne) et du CEPS (114 jours en moyenne en 2015 d'après un rapport de la Cour des comptes). Ces délais n'étant pas imputables à l'industriel, il paraît incohérent d'en faire un motif de majoration des remises dont il pourrait être redevable à l'issue de la phase d'accès précoce.
D'autre part, cette disposition consacrerait incidemment dans la loi un délai dont la nature demeure réglementaire.
C'est pourquoi votre commission a adopté un amendement n° 185 de votre rapporteure supprimant cette référence au délai réglementaire de 180 jours.
4. L'inscription des médicaments sous accès précoce au sein de la rétrocession hospitalière
Comme l'ont indiqué les représentants des industriels à votre rapporteure, le 8° du I du présent projet de loi, visant à réserver à l'usage hospitalier les spécialités bénéficiant d'une AAP, y compris lorsque ces dernières étaient précédemment distribuées en ville , pose un problème d'accessibilité du traitement pour les patients qui en bénéficient dans le cadre d'une AMM prise en charge dans le droit commun.
La commission a adopté un amendement n° 181 de votre rapporteure visant à maintenir dans le circuit de distribution de ville les médicaments sous AAP qui font par ailleurs l'objet d'une AMM.
5. La modification unilatérale par le ministre de la santé des conditions de dispensation de spécialités dans le droit commun, lorsqu'elles font l'objet d'un accès dérogatoire
Cette disposition, autant prévue pour l'accès précoce que pour l'accès compassionnel, autorise le ministre de la santé à modifier les conditions de dispensation d'une spécialité déjà titulaire d'une AMM, lorsque cette dernière fait l'objet d'une AAP ou d'une AAC.
Son maintien dans le texte ne paraît pas souhaitable, dans la mesure où elles pourraient défavorablement impacter l'accès des patients à des traitements normalement disponibles en ville dans le cadre d'une AMM, dès lors que ces derniers feraient l'objet d'une AAP ou d'une AAC au titre d'une extension d'indication. Votre commission a donc adopté un amendement n° 184 de votre rapporteure de suppression de ces dispositions.
6. Une précision quant à la prise en charge des accès compassionnels
Compte tenu des deux modalités possibles de prise en charge par l'assurance maladie pour les accès compassionnels (indemnité maximale réclamée par l'exploitant ou base forfaitaire annuelle définie par arrêté ministériel) et de l'absence de critère régissant l'application de l'une plutôt que l'autre, votre commission a adopté un amendement n° 186 de votre rapporteure visant au moins à assurer le mode de financement par indemnité maximale dans les cas d'AAC visant à déboucher sur une AAP , afin que les mécanismes de prise en charge puissent bénéficier d'une certaine continuité.
7. L'avis de l'Uncam sur la base forfaitaire annuelle des dispositifs médicaux et des spécialités faisant l'objet d'AAC
Votre commission a par ailleurs adopté un amendement n° 188 de votre rapporteure rétablissant l'avis de l'Uncam pour la prise en charge des dispositifs médicaux non-inscrits sur la LPPR et l'élargissant à la base forfaitaire annuelle pouvant servir de base à la prise en charge des AAC.
Votre commission vous demande d'adopter cet article avec les modifications qu'elle a adoptées.
Article 38 bis
(nouveau)
Publicité des montants des investissements publics pour des
spécialités
susceptibles d'être prises en charge par
l'assurance maladie
Cet article, inséré à l'Assemblée nationale, prévoit de rendre publics les montants d'investissement public de recherche et développement reçus par les entreprises pharmaceutiques pour les spécialités qu'ils entendent inscrire au remboursement.
La commission vous demande de l'adopter sans modification.
Cet article additionnel a été intégré par l'Assemblée nationale au présent projet de loi à l'issue de l'adoption d'un amendement du rapporteur général de la commission des affaires sociales, sous-amendé par un sous-amendement de M. Paul Christophe. L'amendement initial prévoyait que les entreprises pharmaceutiques mettent à la disposition du comité économique des produits de santé (CEPS), pour chacun des médicaments inscrits ou ayant vocation à être inscrits sur une liste de spécialités remboursables , le montant des investissements publics de recherche et développement dont elles ont bénéficié . Ce montant serait ensuite rendu public par le CEPS.
Le sous-amendement de M. Christophe rectifie cette disposition, en précisant que cette obligation de déclaration des entreprises s'applique non à raison de chaque médicament qu'elles exploitent, mais à raison de l'ensemble de ces derniers . En effet, comme l'indique l'exposé des motifs, « le dispositif [en tant que tel ne serait pas] inopérant puisque qu'il n'est pas possible de rattacher un avantage à un produit en particulier ». L'adoption de ce correctif, qui rend le dispositif opérationnel, s'est ainsi fait l'écho d'une inquiétude exprimée par les principaux acteurs du médicament.
Jouissant jusqu'à présent de la protection de l'article L. 151-1 du code du commerce, qui régit le secret des affaires , il paraît souhaitable que l'information relative au montant des investissements publics pour des médicaments susceptibles d'être pris en charge par l'assurance maladie soit désormais publiée.
Cette disposition avait déjà été adoptée par le Parlement lors de l'examen de la loi de financement de la sécurité sociale (LFSS) pour 2020, mais, ayant alors été introduite en nouvelle lecture à l'Assemblée nationale, le Conseil constitutionnel l'a jugée sans relation directe avec une disposition du texte restant en discussion et l'a considérée comme contraire à la Constitution 197 ( * ) .
Votre commission vous demande d'adopter cet article sans modification.
Article 39
Renforcer la
qualité des prestations de soins à domicile
Cet article renforce le contrôle des prestataires de services et distributeurs de matériel (PSDM) au moyen d'une certification conditionnant leur remboursement par l'assurance maladie.
La commission vous demande d'adopter cet article sans modification.
I - Le dispositif proposé : un encadrement plus strict d'une activité en fort développement
A. Une activité en croissance et peu contrôlée
1. Une activité en plein développement
Les prestataires de services et distributeurs de matériel (PSDM) sont des professionnels fournissant, à des personnes malades ou présentant une incapacité ou un handicap et vivant à leur domicile, des dispositifs médicaux ou des aides techniques éventuellement assortis de prestations de nature variée - observance du traitement, télésuivi, etc. Ces dispositifs et prestations sont pris en charge par l'assurance maladie dès lors qu'ils figurent sur la liste des produits et prestations remboursables (LPPR) et qu'ils font l'objet d'une prescription médicale.
Comme le souligne le rapport de l'Inspection générale des affaires sociales (IGAS) de janvier 2020 198 ( * ) , cette activité connaît une impressionnante dynamique, portée par la démographie et les évolutions médico-techniques, le virage ambulatoire, mais également par des pratiques de promotion et de prescriptions favorables. La profession revendique près de 2 millions de patients, et près de 3500 établissements de PSDM sont enregistrés par l'assurance maladie, sur l'ensemble du territoire.
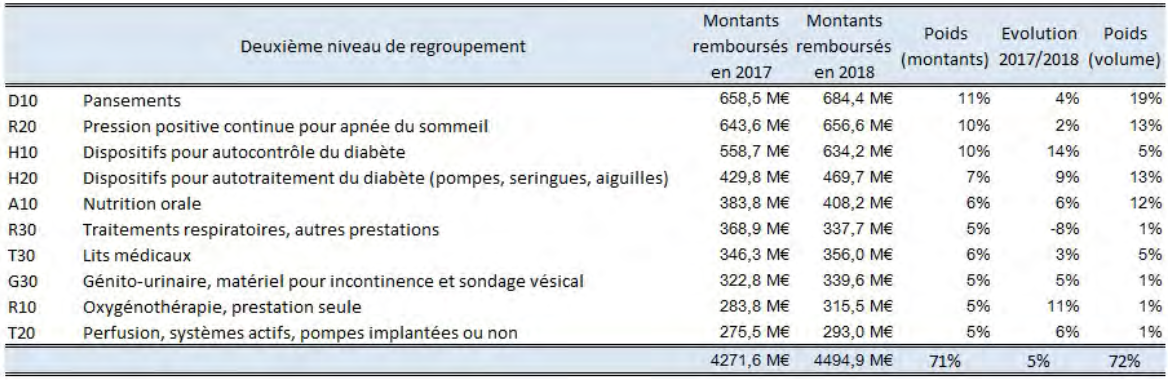
En 2018, les dispositifs et prestations délivrés par les PSDM ont représenté près de 6,4 milliards d'euros de remboursements , en hausse de 30 % depuis 2012. En 2018, 65 % des montants remboursés se concentrent sur cinq postes : appareils respiratoires, métabolisme (diabète essentiellement), maintien à domicile, dermatologie (pansements), et appareils digestifs, ces dépenses étant elles-mêmes concentrées, à hauteur de 71 %, sur dix produits et prestations.
Produits et prestations les plus remboursés en 2018
Source : IGAS, rapport précité
2. Une activité à l'encadrement lâche
Il n'existe pourtant pas de définition positive de la profession dans la loi : elle n'est mentionnée à l'article L. 5232-3 du code de la santé publique, sous les dénominations « prestataires de service et distributeurs de matériels », qu'au travers des obligations qu'elle a de disposer de personnels formés et de respecter des conditions d'exercice et règles de bonne pratique.
C'est seulement par arrêté que, depuis 2006 199 ( * ) , sont définis ses contours.
Les 17 missions réglementaires des PSDM
(extraits de l'arrêté du 19 décembre 2006)
01. La prise en compte de la prescription et de la préconisation de matériels réalisées par l'équipe pluridisciplinaire.
02. L'information, la présentation à la personne ou à son entourage, de plusieurs matériels, s'il y a lieu, pouvant répondre à ses besoins.
03. Les essais de plusieurs matériels, à l'exception des matériels sur mesure, chez le prestataire ou au lieu de vie de la personne.
04. La fourniture de devis.
05. L'information sur les conditions de garantie et la durée de vie habituelle avec remise d'une version actualisée du document d'information et de la notice d'utilisation.
06. La délivrance du matériel, qui doit respecter le choix du patient et, s'il y a lieu, la prescription ou la préconisation par l'équipe pluridisciplinaire.
07. Le rappel des conditions d'utilisation du matériel conformément aux exigences de sécurité, à son entretien, le cas échéant à sa désinfection et à la sécurité de son utilisation.
08. L'établissement des documents nécessaires à la personne et un dossier contenant tous les éléments permettant le suivi de la personne, du matériel et service délivrés.
09. La livraison, si nécessaire, au lieu de vie de la personne.
10. La mise en service et la vérification du bon fonctionnement du matériel dans l'environnement dans lequel il doit être utilisé.
11. La facturation.
12. La mise en place, si nécessaire, d'un service d'astreinte téléphonique.
13. Le service après-vente, la maintenance et les réparations comprenant l'intervention technique sur un matériel défectueux soit au local professionnel, soit au lieu de vie.
14. S'il y a lieu, le contrôle régulier de l'observance, en vue d'alerter le médecin traitant en cas d'anomalies.
15. Le contrôle, s'il y a lieu, de la bonne utilisation du matériel, le rappel éventuel des informations, en coordination avec l'équipe médicale et les auxiliaires médicaux.
16. Le signalement des incidents ou risques d'incidents de matériovigilance résultant de l'utilisation de dispositifs médicaux, conformément à la réglementation en vigueur.
17. En cas de location, la récupération du matériel, si nécessaire au lieu de vie de la personne, le nettoyage et la désinfection et la vérification technique du matériel.
Seule la dispensation de l'oxygène à usage médical fait l'objet d'une réglementation particulière : une autorisation administrative préalable est nécessaire à toute activité.
Les autres activités des PSDM ne sont soumises qu'à une contrainte, celle d'un enregistrement auprès de l'assurance maladie pour pouvoir facturer et bénéficier des remboursements prévus par la LPP. Il s'agit d'une démarche légère, effectuée depuis 2012 auprès des CPAM. L'assurance maladie se contente de vérifier le dossier ; elle visite parfois les locaux. Cet enregistrement provoque l'inscription du PSDM au fichier national des professionnels de santé de l'assurance maladie (FNPS).
L'adhésion à la convention nationale est généralisée mais facultative. Elle permet la pratique du tiers-payant, sous réserve d'un engagement à respecter les termes de la convention, dans son double volet de qualité et d'efficience. Le dispositif de sanction est toutefois peu opérant en cas de non-respect des obligations, et les procédures de suspension ou de déconventionnement difficiles à mettre en oeuvre, voire contournées par certains prestataires.
3. Des prestations de qualité variable
Le rapport de l'IGAS de janvier 2020 réitère des constats déjà réalisés exactement quatre ans plus tôt 200 ( * ) : hétérogénéité des activités et des structures, faible niveau d'exigences réglementaires pour exercer cette activité, contrôles très limités opérés par les pouvoirs publics malgré les dérives liées aux effets des pratiques commerciales dans un contexte de forte concurrence, système de paiement à l'acte encourageant l'accroissement des volumes.
Cette analyse est, en 2020, actualisée et complétée par au moins deux séries de considérations :
- la nature des activités se transforme. La plupart des PSDM se sont positionnés sur une mission de coordination des sorties d'hospitalisation, à l'interface des services hospitaliers et des professionnels du premier recours, rôle dont ils revendiquent désormais la reconnaissance réglementaire. Ce positionnement a été rendu possible à la fois par la réactivité reconnue de ces professionnels mais également par des pratiques d'entrisme dans les établissements qui posent question ;
- les relations avec les autres acteurs du système de soin se resserrent, et l'on assiste à la création de filières de santé intégrées par alliances et/ou intégration entre les PSDM et des acteurs du soin et parfois du social, peu identifiées par les pouvoirs publics. Il s'agit par exemple de plateformes numériques mettant en réseau l'offre d'un PSDM, d'infirmiers libéraux, d'ergothérapeutes et d'opérateurs de services au domicile, ou de la constitution de réseaux d'infirmiers libéraux spécialisés dans les soins associés à certains dispositifs médicaux.
De telles transformations conduisent l'IGAS à faire « un bilan nuancé de l'impact des PSDM sur l'efficience des parcours ». Les pratiques de contrôle des organismes d'assurance maladie restent hétérogènes. Quand des contrôles sont réalisés, ils révèlent des manquements - en matière d'hygiène ou de respect du droit de la consommation ou de la concurrence - parfois qualifiés d'« inquiétants ».
B. Le dispositif proposé : un encadrement des PSDM par une certification conditionnant le remboursement
1. Une procédure de certification établie par la HAS
Le 1° du I. confie, à l'article L. 161-37 du code de la sécurité sociale, deux nouvelles missions à la Haute autorité de santé, consistant à établir un référentiel des bonnes pratiques professionnelles des PSDM et établir et mettre en oeuvre des procédures de certification de ces professionnels ( a) ). Il précise en outre ( b) ) que pour cette nouvelle mission également, la HAS prend en compte les risques de maltraitance.
Le 1° du II. précise que ce référentiel de bonnes pratiques professionnelles est rendu public au plus tard le 31 décembre 2021.
Ces dispositions reprennent la première préconisation du rapport de l'IGAS précité, qui estimait que la réalisation de cette procédure et son actualisation pouvait être confiées à la HAS, avec l'appui de l'ANSM, en s'appuyant sur les référentiels ou labels existants et portés par la profession (QUALIPSAD, label Responsabilité & Santé, Cap Handéo...), et sur les exigences de la norme générale ISO 9001.
2. Une certification conditionnant le conventionnement avec l'assurance maladie
Le 2° du I. complète l'article L. 165-6 du code de la sécurité sociale, relatif aux accords que les organismes d'assurance maladie peuvent conclure avec les distributeurs de produits et prestations de santé. Il ramasse dans un I les dispositions actuelles relatives aux modalités de conventionnement entre l'Uncam et les pharmacies d'officine, et crée un II consacré au conventionnement entre l'Uncam et les PSDM, qui présente les caractéristiques suivantes :
- l'Uncam est autorisée à conclure, à l'échelon national, avec un ou plusieurs syndicats ou organisations regroupant des PSDM, un accord relatif aux produits et prestations de ces professionnels portant sur la qualité ou les prix maximaux pratiqués, ainsi que sur les modalités de délivrance et de prise en charge de ces produits et prestations (premier alinéa) ;
- l'accord devra prévoir des dispositions adaptées à la situation des bénéficiaires de la complémentaire santé solidaire, dans les mêmes conditions que les accords existants avec les pharmacies d'officine, et emportant les mêmes conséquences en cas de manquement - un arrêté ministériel pouvant alors fixer les obligations s'imposant aux distributeurs (second alinéa) ;
- pourront seuls adhérer à cet accord les PSDM détenant la certification précitée. L'adhésion conventionnelle sera notamment conditionnée, précise l'étude d'impact, par une déclaration annuelle des PSDM de leurs champs d'activités, de leur volume d'activité, de leur territoire d'intervention et des qualifications en leur sein.
Le 3° du I. est de coordination.
3. Un conventionnement conditionnant le remboursement par l'assurance maladie
Le troisième alinéa du II de l'article L. 165-6 préciserait encore que les produits et prestations délivrés par un PSDM ne seraient pris en charge par l'assurance maladie que si celui-ci a adhéré à l'accord prévu précédemment ou si cet accord lui a été rendu applicable. À défaut, ces produits et prestations ne peuvent être pris en charge que si le professionnel détient la certification. Les conditions de mise en oeuvre de ces dernières dispositions seront précisées par décret en Conseil d'État, et entrent en vigueur le 1 er janvier 2023.
L'étude d'impact estime à 30 millions d'euros le montant des économies que cette certification pourrait générer chaque année dès 2023 pour l'assurance maladie.
II - Les modifications apportées à l'Assemblée nationale
L'Assemblée nationale a adopté cet article tel que modifié par deux amendements rédactionnels du rapporteur général.
III - La position de la commission : adoption conforme
La commission se réjouit que la préconisation formulée par l'IGAS en début d'année ait trouvé une si rapide traduction législative. Elle sera attentive à ce que les autres préconisations de la mission soient également suivies : la régulation plus efficace des pratiques commerciales et des conflits d'intérêts par la mise en oeuvre de la réglementation existante, la recherche d'efficience dans l'organisation des sorties d'hospitalisation, la meilleure répartition des rôles et responsabilités dans le pilotage des réformes réglementaires (direction générale de l'offre de soins), et la régulation individuelle des PSDM (assurance maladie), etc.
La commission vous demande en conséquence d'adopter cet article sans modification.
Article
40
Simplification du pilotage de la complémentaire santé
solidaire
Cet article propose de supprimer le Fonds de la Complémentaire santé solidaire et de répartir ses missions entre l'assurance maladie, l'État et les organismes de recouvrement.
La commission vous demande d'adopter cet article modifié par les amendements qu'elle a adoptés.
I - Le pilotage de la Complémentaire santé solidaire par un établissement public, le Fonds C2S
A. Le mouvement de rationalisation de la protection complémentaire en matière de santé destinée aux populations précaires
La loi de 1999 portant création d'une couverture maladie universelle 201 ( * ) a institué un fonds, dénommé « Fonds de financement de la couverture maladie universelle complémentaire » (Fonds CMU-c), chargé de financer la couverture des dépenses relevant de la protection complémentaire en matière de santé prévue aux articles L. 861-1 et suivants du code de la sécurité sociale.
La loi de financement de la sécurité sociale (LFSS) pour 2019 202 ( * ) ayant fusionné la couverture maladie universelle complémentaire (CMU-c) avec l'aide au paiement d'une complémentaire santé (ACS) afin de créer la Complémentaire santé solidaire (C2S), le fonds a en conséquence été rebaptisé « Fonds de la Complémentaire santé solidaire » (Fonds C2S) par la LFSS pour 2020 203 ( * ) .
Depuis le 1 er novembre 2019, la C2S offre une complémentaire santé gratuite aux personnes dont les revenus annuels sont inférieurs à un plafond 204 ( * ) , et permet aux personnes dont le revenu est compris entre 1 et 1,35 fois ce plafond de bénéficier de la même protection complémentaire moyennant une participation financière mensuelle calculée en fonction de leur âge 205 ( * ) .
B. Un établissement public administratif au coeur du circuit financier de la C2S
Le Fonds C2S est un établissement public national à caractère administratif employant 10 équivalents temps plein (ETP) 206 ( * ) .
Un décret fixe la composition de son conseil d'administration, constitué de représentants de l'État, ainsi que la composition du conseil de surveillance, comprenant notamment trois députés et trois sénateurs, des représentants d'associations oeuvrant dans le domaine économique et social en faveur des populations les plus démunies, des représentants des régimes obligatoires d'assurance maladie et des représentants des organismes de protection sociale complémentaire 207 ( * ) . Le président du conseil de surveillance est nommé par arrêté du ministre chargé de la sécurité sociale parmi les parlementaires qui en sont membres.
Aux termes de l'article L. 862-2 du code de la sécurité sociale, les dépenses du fonds sont constituées :
- d'une part, par le remboursement aux organismes gestionnaires de la C2S des sommes correspondant à la prise en charge des prestations servies à ce titre, après minoration du montant de la participation due à l'organisme par l'assuré, lorsque celui-ci est soumis à participation financière, et majoration à hauteur d'un montant forfaitaire attribué aux organismes complémentaires au titre leurs frais de gestion ;
- d'autre part, par les frais de gestion administrative du fonds .
L'article L. 862-3 du code de la sécurité sociale prévoit que les recettes du fonds sont exclusivement constituées d'une fraction du produit de la taxe de solidarité additionnelle sur les complémentaires santé (TSA) .
En pratique, les organismes complémentaires minorent le montant dû de TSA du montant de leurs dépenses de C2S. Dans le cas où le montant devant lui être remboursé au titre de la C2S excède le montant de TSA dû par un organisme complémentaire, la différence lui est reversée par l'URSSAF d'Île-de-France, chargée du recouvrement de la TSA 208 ( * ) .
Le montant de TSA alloué au Fonds C2S couvre strictement le montant de ses dépenses afin d'équilibrer son résultat annuel. Le solde de TSA est ainsi reversé à la CNAM.
C. Les diverses missions à la charge du fonds
Outre le financement de la C2S, le fonds exerce différentes missions en application des articles L. 861-7 et L. 862-7 du code de la sécurité sociale :
- la gestion de la liste des organismes complémentaires habilités à gérer la C2S ;
- la fiabilisation des déclarations de TSA et des déductions réalisées au titre de la C2S ;
- le recueil et l'analyse de statistiques relatives à la C2S et à ses bénéficiaires.
Le fonds établit ainsi un rapport public annuel, remis au Parlement avant le 15 novembre, faisant apparaître notamment le nombre et l'âge des bénéficiaires de la C2S, l'évolution du montant des participations versées par les bénéficiaires concernés, ainsi que l'évolution du montant des cotisations d'assurance maladie complémentaire et de celui des prestations afférentes à la C2S.
Au titre de sa mission d'analyse, il a produit différentes études sur la C2S et les dispositifs auxquels elle a succédé, notamment en matière d'accès aux soins des publics concernés.
II - Le dispositif envisagé : une suppression du Fonds C2S à des fins de simplification
Le Fonds C2S figure dans la liste des structures comptant un faible nombre d'agents qu'il a été décidé de supprimer à l'issue du 4 e comité interministériel de la transformation publique (CITP) du 15 novembre 2019 209 ( * ) .
L'article 40 abroge ainsi la structure juridique du fonds et, sans modifier le mécanisme du financement de la C2S, répartit ses missions entre l'administration centrale du ministère des solidarités et de la santé, l'Agence centrale des organismes de sécurité sociale (ACOSS) et la Caisse nationale de l'assurance maladie (CNAM) ( I ).
Ces dispositions entreraient en vigueur au 1 er janvier 2021 ( II ). Les modalités du transfert à la CNAM, à l'ACOSS et à l'État des biens du Fonds C2S doivent être fixées par décret, tandis qu'un décret en Conseil d'État doit préciser les conditions d'établissement des comptes du Fonds C2S relatifs à l'exercice 2020 et de leur transfert au 1 er janvier 2021 ( III ).
A. Le transfert à la CNAM du financement de la C2S
Le 2° du I créé, au sein de la CNAM, un fonds de financement de la C2S .
Ce transfert à la CNAM entraîne la suppression du poste de dépenses lié aux frais de gestion administrative du Fonds C2S.
La CNAM est donc chargée de transmettre au Gouvernement, au plus tard au 1 er septembre de chaque année, l'état des sommes correspondant au remboursement aux organismes gestionnaires de la C2S ( 3° du I ).
Elle devra par ailleurs transmettre trimestriellement à l'ACOSS les données nécessaires au contrôle des montants de ces remboursements ( 4° du I ).
La fraction de TSA dédiée au financement de la C2S serait par conséquent affectée à la CNAM.
Les biens, disponibilités, capitaux propres, créances et dettes représentatifs des droits et obligations du Fonds C2S directement afférents au financement de la protection en matière de santé ainsi que les engagements qui en découlent seraient transférés à la CNAM au 1 er janvier 2021 ( 1° du III ).
B. La poursuite par l'ACOSS de la mission de fiabilisation des déclarations de TSA
L'ACOSS dispose, à travers le réseau des URSSAF 210 ( * ) , d'une compétence générale de contrôle de la TSA.
En abrogeant l'habilitation du fonds à procéder à toute vérification relative à l'assiette de la TSA ou au calcul des demandes de remboursement au titre de la C2S 211 ( * ) , le a) du 5° du I fait ainsi de l'ACOSS le seul organisme chargé de cette mission.
En conséquence, les biens, disponibilités, capitaux propres, créances et dettes représentatifs des droits et obligations du Fonds C2S directement afférents à la mise en oeuvre du contrôle de l'assiette de la TSA ou des vérifications relatives au calcul des demandes de remboursements de C2S, ainsi que les engagements qui en découlent, seraient transférés à l'ACOSS au 1 er janvier 2021 ( 2° du III ).
C. La reprise par la DSS de la liste des organismes gestionnaires et des missions de recueil et d'analyse statistique
Le 1° du I confie au ministre chargé de la sécurité sociale le soin d'établir, de diffuser et de gérer la liste des organismes complémentaires participant à la C2S. En pratique, cette mission incomberait à la direction de la sécurité sociale (DSS).
Les biens, disponibilités, capitaux propres et obligations du Fonds C2S nécessaires à l'établissement de cette liste seraient en conséquence transférés à l'État au 1 er janvier 2021 ( 3° du III ).
Le ministre serait également le destinataire des informations relatives aux bénéficiaires, aux participations versées par ces derniers et à l'état des dépenses et des recettes au titre de la C2S devant être communiquées par les organismes complémentaires d'assurance maladie (OCAM) en application de l'article L. 862-7 du code de la sécurité sociale. Il recueillerait, de même, les informations relatives aux personnes prises en charges actuellement communiquées au Fonds C2S par les organismes de sécurité sociale ( b) du 5° du I ).
L'Autorité de contrôle prudentiel et de résolution (ACPR) serait seule chargée de transmettre chaque année, avant le 1 er juin, au Gouvernement et au Parlement les données nécessaires à l'établissement des comptes des organismes gestionnaires ( c) du 5° du I ).
C'est enfin le ministre chargé de la sécurité sociale qui établirait le rapport public annuel sur la C2S, qui serait remis avant le 31 décembre au Parlement et non avant le 15 novembre ( d) et e) du 5° du I ).
Répartition des missions actuelles du Fonds C2S à la suite de la réforme
|
Activité du Fonds C2S |
Organisme chargé de reprendre l'activité |
|
Financement de la C2S |
Caisse nationale de l'assurance maladie |
|
Transmission au Gouvernement de l'état des remboursements aux OCAM |
Caisse nationale de l'assurance maladie |
|
Fiabilisation des déclarations de TSA et des déductions des remboursements de C2S |
Agence centrale des organismes de sécurité sociale |
|
Gestion de la liste des organismes participant à la C2S |
Ministre chargé de la sécurité sociale |
|
Recueil des informations relatives aux bénéficiaires, aux participations versées par ces derniers et à l'état des dépenses et des recettes au titre de la C2S communiquées par les OCAM |
Ministre chargé de la sécurité sociale |
|
Recueil des informations relatives aux personnes prises en charge communiquées par les organismes de sécurité sociale |
Ministre chargé de la sécurité sociale |
|
Transmission au Gouvernement et au Parlement, avant le 1 er juin, des données nécessaires à l'établissement des comptes des organismes gestionnaires |
Autorité de contrôle prudentiel et de résolution |
|
Établissement et remise au Parlement du rapport public annuel sur la C2S |
Ministre chargé de la sécurité sociale |
Selon l'évaluation préalable, un comité de pilotage, présidé par le directeur de la sécurité sociale , sera constitué à la place du comité de surveillance du Fonds C2S afin de regrouper l'ensemble des parties prenantes intéressées aux politiques d'accès aux soins des populations précaires (associations, caisses de sécurité sociale, administration).
D. La suppression d'une possibilité pour les OCAM de s'organiser au sein d'associations
Le 6° du I réécrit l'article L. 862-8 du code de la sécurité sociale pour y mentionner la possibilité pour les organismes gestionnaires, actuellement prévue à l'article L. 862-1, de créer un fonds d'accompagnement à la protection complémentaire des personnes dont les ressources sont supérieures au plafond de la C2S sans participation financière.
Ce faisant, il supprime la possibilité pour les organismes complémentaires de créer des associations dont la mission est de mettre en oeuvre pour leur compte l'ensemble des opérations (déclaration, paiement) liées à la TSA. Cette disposition, qui semble n'avoir jamais été utilisée par les complémentaires, est en effet devenue obsolète.
III - Les modifications adoptées par l'Assemblée nationale
À l'Assemblée nationale, deux amendements rédactionnels ont été adoptés à l'initiative du rapporteur.
L'Assemblée nationale a adopté cet article ainsi modifié.
IV - La position de la commission : un rôle d'information et d'espace de dialogue à assurer
Les organismes complémentaires - représentés par la Mutualité française, le Centre technique des institutions de prévoyance (CTIP) et la Fédération française de l'assurance (FFA) - ont émis des réserves de forme et de fond sur cette mesure. Ils demandent notamment, en tant que financeurs de la C2S, à continuer d'être associés, selon des modalités à définir, au pilotage et au suivi du dispositif.
Pour l'ACOSS, interrogée par la rapporteure, cette réorganisation apporterait cependant plus de cohérence entre les opérations de fiabilisation de la TSA opérées par le fonds et les contrôles opérés par les Urssaf.
La rapporteure souligne néanmoins l'expertise reconnue du Fonds C2S en matière d'accès aux soins des bénéficiaires de la C2S et la nécessité de conserver cette compétence , d'autant plus importante que l'accès aux soins de cette population reste précaire. Il convient également de mentionner le rôle d'information et d'espace de dialogue du fonds.
Afin de transférer à une structure existante ces compétences du fonds, la commission a adopté, à l'initiative de la rapporteure, un amendement prévoyant que le Conseil national des politiques de lutte contre la pauvreté et l'exclusion sociale (CNLE) rend un avis sur le rapport annuel sur la C2S , désormais établi par le ministre en charge de la sécurité sociale. Cet avis serait également transmis au Parlement avant le 31 décembre de l'année considérée (amendement n° 189).
Le Fonds C2S joue également un rôle d'accueil du public en répondant aux questions des potentiels bénéficiaires. Avec la suppression du fonds, les CPAM devront seules assumer cette mission, ce qui suppose une information renforcée de leurs agents.
Au-delà de cette mesure de simplification administrative, il est permis de s'interroger sur la complexité et la circularité des relations financières entre les OCAM et la CNAM . À cet égard, il paraît à la commission possible et souhaitable d'aller plus loin que la suppression formelle du fonds.
La commission a enfin adopté un amendement (n° 190) de la rapporteure corrigeant une erreur de référence.
La commission vous demande d'adopter cet article modifié par les amendements qu'elle a adoptés.
Article 40 bis
(nouveau)
Mission de lutte contre le non-recours
aux droits des
organismes de sécurité sociale
Cet article, inséré par l'Assemblée nationale, propose de confier aux organismes de sécurité sociale une mission générale de lutte contre le non-recours, et d'expérimenter à cette fin un dispositif d'échange et de traitement de données personnelles entre organismes afin d'identifier les droits des bénéficiaires potentiels de prestations.
La commission vous demande d'adopter cet article modifié par l'amendement qu'elle a adopté.
I - Une volonté de donner corps à l'objectif de lutte contre le non-recours aux droits et aux prestations
A. L'inscription dans la loi de la mission de lutte contre le non-recours aux droits des organismes de sécurité sociale
Introduit par l'Assemblée nationale à l'initiative de la députée Christine Cloarec-Le Nabour et de ses collègues du groupe La République en Marche, avec avis favorable du Gouvernement, l'article 40 bis vise à confier aux organismes de sécurité sociale une mission de lutte contre le non-recours aux droits et aux prestations sociales .
La notion de non-recours renvoie à toute personne qui ne reçoit pas, quelle qu'en soit la raison, une prestation ou un service auquel elle pourrait prétendre. Pour l'Observatoire des non-recours aux droits et services (Odenore), « entre non-connaissance, non-orientation, non-proposition, non-réception et non-demande, les situations de non-recours interrogent l'effectivité et la pertinence de l'offre publique, et représentent un enjeu fondamental pour son évaluation . »
Le II crée à cette fin un nouveau chapitre au sein du titre 6 du livre 2 du code de la sécurité sociale, intitulé : « Lutte contre le non recours aux droits et aux prestations ».
Ce chapitre serait constitué d'un nouvel article L. 261-1 qui dispose que les organismes de sécurité sociale « mènent toutes actions de nature à détecter les situations dans lesquelles des personnes sont susceptibles de bénéficier de droits ou de prestations et à accompagner ces personnes dans l'accès à leurs droits et au service des prestations auxquelles elles peuvent prétendre. Ils mènent ces actions, en tant que de besoin, en lien avec les autres administrations ou organismes disposant d'informations pouvant contribuer à identifier les situations de non recours . »
Le I transpose cette mission aux organismes de la mutualité sociale agricole par renvoi à ces dispositions au sein du code rural et de la pêche maritime.
B. L'expérimentation d'un dispositif d'échange et de traitement de données afin de détecter les situations de non-recours
Le III de l'article 40 bis autorise, pendant une durée de trois ans , les organismes de sécurité sociale à traiter et échanger entre eux des données à caractère personnel ou collecter auprès d'autres administrations et de collectivités territoriales ces informations utiles à l'identification des droits de bénéficiaires potentiels, y compris pour des personnes qui ne sont pas connues des organismes de sécurité sociale, afin de détecter les situations dans lesquelles des personnes seraient éligibles à percevoir des prestations sociales dont le bénéfice ne leur a pas encore été ouvert faute de démarche accomplie en ce sens.
Ces échanges et traitements effectués auraient vocation à permettre aux organismes de contacter les personnes susceptibles de bénéficier de prestations afin qu'ils en formulent la demande.
Il est précisé que, dès lors qu'il est confirmé que des personnes ne remplissent pas les conditions d'éligibilité, leurs données traitées dans le cadre de ce dispositif doivent être immédiatement supprimées.
Un décret en Conseil d'État, pris après avis de la Commission nationale de l'informatique et des libertés (CNIL), doit préciser les droits et prestations pour lesquels les échanges et les traitements faisant l'objet du dispositif peuvent être mis en oeuvre, les catégories de données pouvant être utilisées, les garanties apportées aux personnes dans le traitement de leurs données et pour l'exercice de leurs droits.
II - La position de la commission : une expérimentation à encadrer davantage et à recentrer sur une prestation déterminée
La lutte contre le non-recours s'est aujourd'hui hissée au rang de priorité politique. Elle constitue notamment l'une des motivations du projet de création, dans le cadre de la stratégie de prévention et de lutte contre la pauvreté, d'un revenu universel d'activité (RUA).
En matière de prestations de sécurité sociale, sont notamment concernés par ce phénomène, difficile à mesurer, les prestations familiales, les droits à la retraite 212 ( * ) ou les aides sociales à l'accès aux soins à destination des plus modestes. En 2018, le taux de recours à la couverture maladie universelle complémentaire (CMU-C) 213 ( * ) est ainsi estimé entre 56 % et 68 % 214 ( * ) .
Dans ce contexte, confier explicitement aux organismes de sécurité sociale une mission générale de lutte contre le non-recours ouvre la voie à de nouveaux outils pour connaître et traiter ce phénomène. Il est cependant permis de s'interroger sur la portée normative réelle de l'inscription de cet objectif dans la loi. En effet, les caisses de sécurité sociale mènent déjà en pratique des actions de lutte contre le non-recours sans qu'une habilitation législative soit nécessaire.
L'idée d'utiliser les traitements de données des caisses pour repérer le non-recours aux prestations et « aller vers » leurs bénéficiaires potentiels n'est pas nouvelle. Depuis 2017, la CNAF travaille ainsi sur une méthode de repérage du non-recours au sein de ses allocataires en utilisant des méthodes de data mining 215 ( * ) . La nouveauté consiste ici à permettre des échanges d'informations entre administrations ou organismes de sécurité sociale à cette fin.
Sur la forme, la rapporteure relève que le cadre de l'expérimentation proposée au III doit être précisé . En particulier, aucune évaluation des résultats du dispositif n'est prévue avant le terme de l'expérimentation.
De plus, afin de faciliter cette évaluation, d'une part, et de fonder la place de cet article dans une LFSS, d'autre part 216 ( * ) , il serait préférable de recentrer ce dispositif sur une prestation déterminée, qui pourrait être la Complémentaire santé solidaire .
La commission a ainsi adopté, sur la proposition de la rapporteure, un amendement précisant en ce sens le cadre de l'expérimentation et supprimant l'inscription dans le code de la sécurité sociale de la mission de lutte contre le non-recours des caisses (amendement n° 191).
La commission vous demande d'adopter cet article modifié par l'amendement qu'elle a adopté.
Article 41
Modernisation
du financement des syndicats représentatifs
des professionnels de
santé libéraux
Cet article crée un système de financement des syndicats représentatifs des professionnels de santé par le fonds des actions conventionnelles de la Cnam alimenté par une partie de la contribution aux URPS et une dotation de la branche maladie.
La commission vous demande d'adopter cet article sans modification.
I - Le dispositif proposé : créer un financement des syndicats représentatifs des professionnels de santé par le fonds des actions conventionnelles
A. Un financement actuellement éclaté et insuffisant
Le financement de la vie syndicale des professionnels de santé présente aujourd'hui une organisation relativement éclatée.
• Au niveau national , les syndicats des professionnels de santé sont majoritairement financés par le produit des cotisations de leurs adhérents .
Ils bénéficient également d'un financement de la Caisse nationale de l'assurance maladie (Cnam) au titre de leur participation à la vie conventionnelle . Sont concernés par ce financement les syndicats déclarés représentatifs par arrêté ministériel 217 ( * ) . Pour arrêter la liste des organisations représentatives, une enquête de représentativité doit être conduite afin de prendre en compte l'indépendance, une ancienneté minimale de deux ans à compter de la date de dépôt légal des statuts, les effectifs d'adhérents et l'audience des organisation, cette dernière étant établie en fonction des derniers résultats aux élections des unions régionales des professionnels de santé (URPS) 218 ( * ) . Au titre de la vie conventionnelle, les syndicats représentatifs sont en effet amenés à conduire des négociations préalables à la signature des conventions régissant les rapports entre les caisses d'assurance maladie et les professions de santé 219 ( * ) .
Ils jouent aussi un rôle dans l'application des stipulations conventionnelles en participant à des commissions paritaires aux côtés des représentants de l'assurance maladie. Cette participation est donc financée par la Cnam selon des modalités et des montants précisés dans les conventions professionnelles.
En outre, le fonds des actions conventionnelles 220 ( * ) (FAC) de la Cnam permet de financer des aides et des mesures d'accompagnement pour les professionnels de santé conventionnés, décidées dans le cadre conventionnel. Ce fonds finance aussi des actions de formation professionnelle continue. Les ressources de ce fonds sont celles qui lui sont affectées par les syndicats et principalement constituées des cotisations.
• Au niveau régional , les organisations syndicales sont financées en fonction de leur participation aux unions régionales des professions de santé (URPS). Les organisations élues ou désignées pour siéger au sein des URPS bénéficient du produit de la contribution aux URPS (CURPS).
Cette contribution, régie par l'article L. 4031-4 du code de la santé publique, est assise sur le revenu tiré de l'exercice de l'activité libérale du professionnel. Son taux, qui est plafonné à 0,5 % par la loi, est fixé par décret pour chaque profession.
Taux de la CURPS par profession
|
Profession |
Taux |
|
Médecin |
0,5 % |
|
Chirurgien-dentiste, pharmacien, biologiste |
0,3 % |
|
Infirmier, masseur-kinésithérapeute, pédicure-podologue, sage-femme, orthophoniste, orthoptiste |
0,1 % |
Source : article D. 4031-45-1 du code de la sécurité sociale
• Les organisations syndicales représentatives des professionnels de santé sont de plus en plus sollicitées pour la participation à la vie conventionnelle et, plus largement, pour mener des concertations avec les pouvoirs publics sur l'organisation des professions et du système de santé. Or, selon l'étude d'impact annexée au projet de loi, plusieurs syndicats représentatifs ont fait part de leurs difficultés à répondre à ces sollicitations et souhaitent que les financements alloués à la vie syndicale soient renforcés et clarifiés. Ce constat a également été formulé par les syndicats de médecins entendus par la rapporteure.
Par conséquent, le présent article prévoit de clarifier ces financements, en les regroupant dans le fonds des actions conventionnelles, et de renforcer le soutien à la vie syndicale, en affectant une part de la CURPS à ces actions.
B. Un renforcement et une clarification du financement des syndicats nationaux
• Le I modifie l'article L. 221-1-2 du code de la sécurité sociale relatif au fonds des actions conventionnelles.
Le 1° renomme le fonds des actions conventionnelles en « fonds de soutien aux actions conventionnelles et à la représentation des professionnels de santé libéraux »
Le 3° prévoit que le fonds sera organisé en deux sections. La première section financera les actions conventionnelles. Les dispositions relatives au financement de ces actions sont inchangées par le présent article.
Le 6° insère un III au sein de cet article L. 221-1-2 afin de créer une seconde section au fonds. Il prévoit que cette section contribuera à financer la participation des syndicats représentatifs des professionnels de santé libéraux à la vie conventionnelle ainsi qu'aux concertations et consultations organisées par les pouvoirs publics.
Il est précisé que ce fonds sera alimenté, d'une part, par une fraction de la contribution aux URPS et, d'autre part, par une dotation de la branche maladie du régime général dont le montant sera fixé chaque année par arrêté ministériel au regard des frais de participation des organisations aux instances conventionnelles.
La modification proposée définit les critères de répartition des crédits du fonds : ils seront répartis entre les syndicats représentatifs pour chaque profession concernée selon des modalités fixées par décret en Conseil d'État et tenant compte de leur audience ou de leurs effectifs.
Les 2° , 4° , 5° et 7° du I procèdent à des ajustements rédactionnels.
• Le II modifie l'article L. 4031-4 de la santé publique relatif à la contribution aux URPS . Il prévoit que la contribution assise sur le revenu tiré de l'activité libérale de la profession est destinée à soutenir la participation des syndicats représentatifs des professionnels libéraux à la vie conventionnelle. Il est précisé que cette contribution sera affectée au financement des URPS et, pour une part fixée par décret, au financement de la seconde section du fonds de soutien aux actions conventionnelles.
• Le III prévoit que les modifications apportée à la contribution aux URPS entreront en vigueur au titre des contributions dues à compter du 1 er janvier 2021.
II - Les modifications adoptées par l'Assemblée nationale
Outre trois amendements rédactionnels de son rapporteur général, l'Assemblée nationale a adopté un amendement du Gouvernement qui crée une troisième section au sein du fonds des actions conventionnelles à financer les conseils nationaux professionnels, qui sont principalement chargés de proposer aux professionnels de santé des parcours de formation continue 221 ( * ) . L'amendement précise que cette section sera alimentée par une dotation de la branche maladie du régime général dont le montant sera fixé chaque année par arrêté ministériel.
L'Assemblée nationale a adopté cet article ainsi modifié.
III - La position de la commission : adoption conforme
La rapporteure est favorable au dispositif proposé qui améliore la lisibilité des financements alloués aux organisations représentatives des professionnels de santé. Il renforce en outre le soutien financier à ces organisations, par l'affectation de ressources issues des revenus des professionnels mais aussi par une contribution de l'assurance maladie au titre de leur participation aux instances conventionnelles, ce qui apparait tout à fait justifié. En effet, ces organisations, par leur participation à la vie conventionnelle, sont des partenaires des caisses d'assurance maladie dans le déploiement des politiques publiques de santé. Les syndicats de médecins libéraux entendus par la rapporteure sont d'ailleurs favorables au dispositif proposé qui permettra de soutenir leurs actions.
La commission vous demande d'adopter cet article sans modification.
Article 42
Isolement et
contention
Cet article tire les conséquences d'une décision du Conseil constitutionnel censurant le régime actuel de l'isolement et de la contention en établissement de soins psychiatriques et propose un nouveau cadre juridique pour ces pratiques.
La commission vous demande d'adopter cet article sans modification.
I - La pratique de l'isolement et de la contention, dont le recours en établissement de soins psychiatriques est encadré par la loi, a été censurée par le Conseil constitutionnel
A. Des dispositifs privatifs de liberté
1. L'isolement et la contention : des pratiques thérapeutiques de dernier recours strictement définies
Les deux modalités principales de privation de liberté dans le cadre thérapeutique sont l' isolement et la contention . Elles ont été consacrées au niveau législatif par la loi du 26 janvier 2016 222 ( * ) , créant un article L. 3222-5-1 au code de santé publique (CSP). L'introduction de cet article était alors particulièrement nécessaire en l'absence d'encadrement juridique précis de ces pratiques.
Article L. 3222-5-1 du CSP
L' isolement et la contention sont des pratiques de dernier recours . Il ne peut y être procédé que pour prévenir un dommage immédiat ou imminent pour le patient ou autrui, sur décision d'un psychiatre, prise pour une durée limitée . Leur mise en oeuvre doit faire l'objet d'une surveillance stricte confiée par l'établissement à des professionnels de santé désignés à cette fin.
Un registre est tenu dans chaque établissement de santé autorisé en psychiatrie et désigné par le directeur général de l'agence régionale de santé pour assurer des soins psychiatriques sans consentement . Pour chaque mesure d'isolement ou de contention, ce registre mentionne le nom du psychiatre ayant décidé cette mesure, sa date et son heure, sa durée et le nom des professionnels de santé l'ayant surveillée. Le registre, qui peut être établi sous forme numérique, doit être présenté, sur leur demande, à la commission départementale des soins psychiatriques, au contrôleur général des lieux de privation de liberté ou à ses délégués et aux parlementaires.
L'établissement établit annuellement un rapport rendant compte des pratiques d'admission en chambre d'isolement et de contention, la politique définie pour limiter le recours à ces pratiques et l'évaluation de sa mise en oeuvre. Ce rapport est transmis pour avis à la commission des usagers [de l'établissement de santé] et au conseil de surveillance.
En conséquence de cette consécration législative, la Haute Autorité de santé (HAS) a publié en février 2017 une série de recommandations de bonne pratique détaillant les mesures de contention et d'isolement :
- pour la contention : elle peut prendre deux formes principales, la contention physique , qui consiste dans « le maintien ou l'immobilisation du patient en ayant recours à la force physique », et la contention mécanique , qui consiste dans l'utilisation de tous moyens « empêchant ou limitant les capacités de mobilisation volontaire ». Il est indiqué que la contention ne doit intervenir qu'exceptionnellement et en dernier recours, et uniquement dans le cadre d'une mesure d'isolement. Il ne peut y avoir recours à des moyens de « contention mécanique ambulatoire » (la « camisole ») qu'en cas de « troubles psychiatriques gravissimes de longue évolution avec des conduites auto-agressives ou de mutilations répétées » ;
- pour l'isolement : il s'agit du « placement à visée de protection dans un espace dont le patient ne peut sortir librement et qui est séparé des autres patients ». Cette mesure, qui ne doit jamais aller à l'encontre de la dignité de l'intéressé, ne peut être mise en oeuvre que dans des cas très circonscrits et pour des durées très restreintes.
2. Des pratiques strictement limitées à l'hospitalisation sans consentement
L'inscription de l'article L. 3222-5-1 au chapitre du CSP relatif aux soins sans consentement ainsi que les recommandations de bonne pratique de la HAS prescrivent explicitement que la contention et l'isolement ne peuvent être pratiquées que dans des cas d'hospitalisation sans consentement, et jamais dans des cas d'hospitalisation libre .
En effet, en raison de la nature particulière des soins psychiatriques et des origines et motivations spécifiques qui peuvent entourer la demande de soins 223 ( * ) , la prise en charge pour troubles mentaux doit, dans le cas général, obéir au principe du consentement préalable obligatoire du patient , exprimé le cas échéant par son représentant légal, énoncé à l' article L. 3211-1 du CSP . Il s'agit alors de ce que l'on désigne par des « soins psychiatriques libres ».
A contrario , on distingue trois hypothèses en matière de soins psychiatriques sans consentement : l'admission en soins psychiatriques à la demande d'un tiers ou en cas de péril imminent 224 ( * ) , l'admission en soins psychiatriques sur décision du représentant de l'État 225 ( * ) et l'admission en soins psychiatriques ordonnée par une juridiction en cas de déclaration d'irresponsabilité pénale 226 ( * ) . Dans ces trois cas, l'admission est demandée par un tiers .
Trois garanties principales sont prévues en matière de soins sans consentement :
- l' information du patient : l'article L. 3211--3 du CSP dispose que toute personne faisant l'objet de soins psychiatriques en application d'une admission contrainte est, dans la mesure où son état le permet, informée de toute décision de maintien de soins et doit être mise à même de faire valoir ses observations par tout moyen et de manière appropriée à cet état ;
- l' intervention du corps médical : dans le cas d'une admission contrainte, le législateur prévoit un encadrement très étroit du prolongement de l'hospitalisation par le recours au certificat médical. L'article L. 3211-2-2 du CSP prévoit deux certificats médicaux obligatoires dans les 72 heures de l'admission ; l'article L. 3211-11 prévoit que le psychiatre qui participe à la prise en charge du patient peut proposer à tout moment de modifier la forme de cette prise en charge par un certificat médical circonstancié ;
- la saisine du juge des libertés et de la détention (JLD) : cette dernière garantie se justifie par la nature même de l'admission. La saisine du JLD par l'autorité décisionnaire de l'admission est obligatoire dans un délai de douze jours 227 ( * ) (ou de six mois dans le cas d'une admission décidée par le juge dans le cas d'une irresponsabilité pénale). Le JLD dispose de l' avis motivé du psychiatre de l'établissement d'accueil .
Il doit être noté que ces garanties ne sont explicitement prévues que pour l'étape d'admission d'un patient à des soins sans consentement ; aucune disposition législative ne prévoit leur renouvellement en cas de recours à l'isolement ou à la contention.
B. Une censure du Conseil constitutionnel sur le fondement de l'absence de contrôle juridictionnel des mesures d'isolement et de contention
Saisi par la Cour de cassation sur le fondement d'une question prioritaire de constitutionnalité (QPC), le Conseil constitutionnel a apprécié le motif d'un requérant selon lequel l'article L. 3222-5-1 du CSP « méconnaîtrait la liberté individuelle protégée par l'article 66 de la Constitution en ce qu' elle ne prévoit pas de contrôle juridictionnel systématique des mesures d'isolement et de contention mises en oeuvre dans les établissements de soins psychiatriques, non plus qu'aucune voie de recours en faveur de la personne qui en fait l'objet ».
Dans sa décision rendue le 19 juin 2020 228 ( * ) , le Conseil constitutionnel rappelle que l'article 66 de la Constitution, qui consacre le contrôle de l'autorité judiciaire en cas de mesure privative de liberté, n'impose pas pour autant que cette dernière soit préalablement et systématiquement saisie de ces mesures.
Toutefois, le Conseil a estimé que la garantie décrite à l'article L. 3222-5-1 du CSP d'« une durée limitée » pour les mesures d'isolement et de contention ne suffisait pas à rendre effectif le contrôle de l'autorité judiciaire qui doit par définition s'exercer sur ces mesures . Pour garantir leur constitutionnalité, le juge doit au moins pouvoir, aux termes du Conseil, se prononcer sur leur maintien lorsque celui-ci excède une certaine durée.
En conséquence, le Conseil constitutionnel a déclaré l'article L. 3222-5-1 du CSP contraire à la Constitution et statué sur la date de son abrogation, reportée au 31 décembre 2020 .
II - L'article 42 du présent projet de loi ouvre la saisine du juge des libertés et de la détention aux cas d'isolement et de contention, sans en faire une saisine générale
A. Une redéfinition de l'office du juge des libertés et de la détention dans le contentieux de l'hospitalisation sans consentement
En conformité avec la décision du Conseil constitutionnel, l'article 42 du présent projet de loi redéfinit l'office du JLD de sorte à rendre son recours effectif en cas de mesure d'isolement ou de contention.
Pour cela, le a) du 2° complète les cas de saisine du juge en matière d'hospitalisation sans consentement, en y intégrant la « mainlevée d'une mesure d'isolement ou de contention ». Le c) porte la même modification au cas d'autosaisine. Le d) opère la coordination avec le pouvoir reconnu au juge d'ordonner la mainlevée.
Le b) du 2° évoque le cas où la saisine est formée par un parent ou une personne susceptible d'agir dans l'intérêt du patient, en précisant que ces derniers doivent être « identifiés ».
Le 3° considère la saisine obligatoire du JLD par le directeur de l'établissement en cas d'hospitalisation sans consentement et précise que, si le juge n'ordonne pas la mainlevée de la mesure d'hospitalisation, il statue néanmoins, le cas échéant, sur le maintien d'une mesure d'isolement ou de contention.
Le 4° détaille la procédure applicable en cas de saisine du JLD pour une mesure d'isolement ou de contention. Contrairement au contentieux de l'hospitalisation sans consentement, le juge devra statuer sans audience et selon une procédure écrite, sauf s'il estime nécessaire de tenir une audience. L'audience reste par ailleurs de droit si elle est demandée par le patient ou, le cas échéant, le demandeur. Toutefois, si des motifs médicaux font obstacle à l'audition du patient, ce dernier est représenté par ministère d'avocat. Il n'est pas fait d'obstacle, si un avis médical y habilite le patient et si lui-même ou le demandeur en donne l'accord, à l'audition du patient par un moyen de télécommunication audiovisuelle ou par communication téléphonique.
Le 5° applique cette même procédure au cas d'un appel formé à l'encontre d'une ordonnance d'un JLD statuant sur le maintien d'une mesure d'isolement ou de contention.
B. Une nouvelle version de l'article L. 3222-5-1 du CSP
Le 1° de l'article 42 du présent projet de loi propose une nouvelle version de l'article L. 3222--5-1 du CSP, qui reprend l'épure de l'ancienne en y apportant les précisions requises par la décision du Conseil constitutionnel. Ces dernières sont de plusieurs types.
1. Un recours mieux encadré
En premier lieu, les conditions de recours à la mesure d'isolement ou à la mesure de contention sont davantage encadrées.
Il est ainsi expressément mentionné que seul le cadre de l'hospitalisation complète sans consentement peut s'y prêter. La décision du psychiatre conduisant à ces mesures devra désormais être motivée et ne pourra être appliquée qu'après prise en compte des adaptations et du caractère nécessaire et proportionnel de la mesure à chaque patient. En outre, la mesure devra également figurer dans le dossier médical .
Ensuite, l'article précise les limites de temps dans lesquelles ces mesures peuvent s'appliquer, étant souligné que la contention ne peut intervenir que dans le cadre d'une mesure d'isolement. Ces limites de temps distinguent les cas normaux des cas exceptionnels .
|
Isolement |
Contention |
|
Durée de 12 heures , avec renouvellement possible par périodes maximales de 12 heures, dans la limite d'une durée totale de 48 heures |
Durée de 6 heures , avec renouvellement possible par périodes maximales de 6 heures, dans la limite d'une durée totale de 24 heures |
|
À titre exceptionnel, la mesure peut être renouvelée au-delà des durées limitatives prévues, toujours dans le respect des périodes maximales |
|
Il est toutefois indiqué que ces limites de temps ne s'exercent que dans le cadre d'une mesure (d'isolement ou de contention) prise isolément. En effet, une mesure peut succéder à une autre, et se voir appliquer les mêmes limites de renouvellement, tant qu'un délai minimal de 48 heures les sépare .
2. Les nouveaux cas d'intervention du juge
Le nouvel article L. 3222-5-1 du CSP prévoit par ailleurs de nouvelles conditions d'intervention du juge des libertés et de la détention, dont le contrôle pourra prendre deux formes :
- il ressort de l'économie du texte que l'information du JLD par le médecin n'est obligatoire et systématique que dans le cas d'un renouvellement exceptionnel d'une mesure d'isolement ou de contention, ou bien dans le cas d'une quatrième mesure d'isolement ou de contention décidée sur une période de quinze jours . Est alors ouverte la possibilité pour la personne concernée de saisir le juge, ou pour ce dernier de s'autosaisir, auquel cas son ordonnance doit être rendue dans les 24 heures ;
- par ailleurs, est reconnu au JLD une faculté de contrôle sur toute mesure de contention ou d'isolement, qu'il ne peut néanmoins exercer qu'au moment où il statue sur la mesure d'hospitalisation .
Votre rapporteure déduit du dispositif que la nouvelle saisine du JLD instaurée par le présent article 42 restera donc limitée à quelques cas déterminés, loin de couvrir l'ensemble des occurrences .
C. Des clarifications apportées par l'Assemblée nationale
Outre un amendement rédactionnel, l'Assemblée nationale a adopté trois amendements de précision au dispositif de l'article 42 :
- une précision sur la durée « maximale » de 12 heures et de 6 heures des mesures d'isolement et de contention ;
- une précision sur les modalités d'information des personnes ayant intérêt à saisir le juge en cas de prolongement exceptionnel des mesures d'isolement et de contention ;
- une précision sur les modalités d'audition du patient par communication audiovisuelle ou téléphonique, qui ne nécessiteront que son accord.
III - La position de la commission : une intention utile mais un cavalier législatif
Pour reprendre les propres termes du rapporteur général de l'Assemblée nationale, on ne peut que « s'interroger sur la place de cette mesure en loi de financement de la sécurité sociale », qui ne rentre manifestement pas dans le périmètre limitatif des LFSS défini à l'article LO. 111-3 du code de la sécurité sociale.
Bien que consciente de l'urgence à substituer une disposition nouvelle à la disposition censurée par le Conseil constitutionnel, et sensible au risque juridique auquel seraient exposés les établissements de soins psychiatriques, votre commission n'en reste pas moins attachée au principe fondamental de lisibilité et de sincérité des débats parlementaires , qui commande qu'un véhicule législatif soit le lieu de discussion de dispositions cohérentes et réunies par un même objet.
La commission vous demande néanmoins d'adopter cet article sans modification.
* 190 Les officines ne pouvant distribuer que des médicaments ayant obtenu l'AMM.
* 191 « Médicaments innovants : consolider le modèle français d'accès précoce », n 569, 2017-2018.
* 192 Loi n° 2018-1203 du 22 décembre 2018 de financement de la sécurité sociale pour 2019, article 65.
* 193 Article L. 162-16-5-1-1 du CSS.
* 194 Loi n° 2019-1446 du 24 décembre 2019 de financement de la sécurité sociale pour 2020, article 44.
* 195 L'AAC devenant dans ce dernier cas une sorte de « dérogation dans la dérogation ».
* 196 Comme nouvelle exception à cette possibilité laissée à l'exploitant de définir son indemnité maximale, l'article prévoit le cas où le médicament en question fait l'objet d'un prix maximal de vente aux établissements de santé défini par arrêté ministériel (article 44 de la LFSS pour 2020).
* 197 Décision n° 2019-795 DC du 20 décembre 2019.
* 198 « Missions des prestataires de services et distributeurs de matériel », janvier 2020.
* 199 Arrêté du 19 décembre 2006 définissant les modalités de la délivrance mentionnées aux articles D. 5232-10 et D. 5232-12 et fixant la liste des matériels et services prévue à l'article L. 5232-3 du code de la santé publique.
* 200 « Dispositifs médicaux : circuits et marges de distribution en ville et rôle des prestataires à domicile », janvier 2014.
* 201 Loi n° 99-641 du 27 juillet 1999 portant création d'une couverture maladie universelle.
* 202 Loi n° 2018-1203 du 22 décembre 2018 de financement de la sécurité sociale pour 2019 - Article 52.
* 203 Loi n° 2019-1446 du 24 décembre 2019 de financement de la sécurité sociale pour 2020 - Article 46.
* 204 Fixé par décret à 8 723 euros pour une personne seule à compter du 1 er novembre 2019.
* 205 De 8 euros pour les assurés âgés de moins de 30 ans, à 30 euros pour les assurés âgés de 70 ans et plus.
* 206 Cf. évaluation préalable de l'article 40 du PLFSS.
* 207 Art. L. 862-1 du code de la sécurité sociale.
* 208 Cf. évaluation préalable.
* 209 Cf. dossier de presse du 4 e comité interministériel de la transformation publique, annexe 2.
* 210 Unions de recouvrement des cotisations de sécurité sociale et d'allocations familiales.
* 211 Art. L. 862-7 du code de la sécurité sociale.
* 212 Selon la DREES, un tiers des assurés n'ont pas fait valoir tous leurs droits à la retraite à 70 ans (Le non-recours aux prestations sociales, dossier n° 57, juin 2020).
* 213 Il s'agit de l'ancien dispositif correspondant à la Complémentaire santé solidaire sans participation de l'assuré.
* 214 Source : DREES.
* 215 Exploration de données.
* 216 En effet, d'autres prestations versées par les organismes de sécurité sociale et pouvant faire l'objet d'une telle expérimentation sont étrangères au champ de la sécurité sociale, tels le revenu de solidarité active (RSA), la prime d'activité et les aides au logement.
* 217 Art. L. 162-33 du code de la sécurité sociale.
* 218 Articles R. 162-54 et R. 162-54-1 du code de la sécurité sociale.
* 219 De plus amples informations sur ces conventions figurent au commentaire de l'article 33.
* 220 Art. L. 221-1-2 du code de la sécurité sociale.
* 221 Art. L. 4021-3 du code de la santé publique.
* 222 Loi n° 2016-41 du 26 janvier 2016 de modernisation de notre système de santé, article 72.
* 223 Les modalités de soins psychiatriques font l'objet du titre I er du livre II de la troisième partie du code de la santé publique.
* 224 Qui fait l'objet du chapitre II du titre susvisé.
* 225 Qui fait l'objet du chapitre III du titre susvisé.
* 226 Article 706-135 du code de procédure pénale.
* 227 Ce délai a donné son titre à un documentaire réalisé en 2017 par Raymond Depardon.
* 228 Décision n° 2020-844 QPC du 19 juin 2020.